Benzaldehyd
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Benzolcarbaldehyd
| |||
| Bevorzugter IUPAC-Name
Benzaldehyd | |||
| Andere Bezeichnungen
Benzol-Carboxaldehyd
Phenylmethanal Benzoesäurealdehyd | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 1990 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C7H6O | ||
| Molekulare Masse | 106.124 g-mol-1 | ||
| Erscheinungsbild | farblose Flüssigkeit stark lichtbrechend | ||
| Geruch | mandelartig | ||
| Dichte | 1,044 g/ml, flüssig | ||
| Schmelzpunkt | -57,12 °C (-70,82 °F; 216,03 K) | ||
| Siedepunkt | 178,1 °C (352,6 °F; 451,2 K) | ||
Löslichkeit in Wasser
|
6,95 g/L (25 °C) | ||
| log P | 1.64 | ||
Magnetische Suszeptibilität (χ)
|
-60,78-10-6 cm3/mol | ||
Brechungsindex (nD)
|
1.5456 | ||
| Viskosität | 1.321 cP (25 °C) | ||
| Thermochemie | |||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-36,8 kJ/mol | ||
Std. Bildungsenthalpie
Verbrennung (ΔcH⦵298) |
-3525,1 kJ/mol | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|

| ||
Signalwort
|
Warnhinweis | ||
Gefahrenhinweise
|
H302 | ||
Sicherheitshinweise
|
P264, P270, P301+P312, P330, P501 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 64 °C (147 °F; 337 K) | ||
Selbstentzündung
temperatur |
192 °C (378 °F; 465 K) | ||
| Explosionsgrenzen | 1.4–8.5% | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (Mittlere Dosis)
|
1300 mg/kg (Ratte, oral) | ||
| Sicherheitsdatenblatt (SDS) | J. T. Baker | ||
| Verwandte Verbindungen | |||
Verwandte Verbindungen
|
Benzylalkohol Benzoesäure | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Benzaldehyd (C6H5CHO) ist eine organische Verbindung, die aus einem Benzolring mit einem Formylsubstituenten besteht. Es ist der einfachste aromatische Aldehyd und einer der industriell am meisten genutzten. ⓘ
Es handelt sich um eine farblose Flüssigkeit mit einem charakteristischen mandelartigen Geruch. Benzaldehyd ist der Hauptbestandteil von Bittermandelöl, kann aber auch aus einer Reihe anderer natürlicher Quellen extrahiert werden. Synthetisches Benzaldehyd ist der Aromastoff in Mandelimitat-Extrakt, der zum Aromatisieren von Kuchen und anderen Backwaren verwendet wird. ⓘ
Benzaldehyd [ˈbɛnt͡s|aldehyːt], die Hauptkomponente in Bittermandelöl, ist eine farblose bis gelbliche Flüssigkeit mit bittermandelartigem Geruch. Benzaldehyd ist der einfachste aromatische Aldehyd, der in vielen ätherischen Ölen vorkommt. Er leitet sich vom Benzol ab und ist chemisch und strukturell eng mit der Benzoesäure verwandt, die aus ihm durch Oxidation gewonnen werden kann. Er ist eine wichtige Grundchemikalie. ⓘ
Geschichte
Benzaldehyd wurde erstmals 1803 von dem französischen Pharmazeuten Martrès extrahiert. Seine Experimente konzentrierten sich auf die Aufklärung der Natur des Amygdalins, des giftigen Stoffes in der Bittermandel, der Frucht von Prunus dulcis. Pierre Robiquet und Antoine Boutron-Charlard, zwei französische Chemiker, arbeiteten weiter an dem Öl und stellten Benzaldehyd her. Im Jahr 1832 synthetisierten Friedrich Wöhler und Justus von Liebig erstmals Benzaldehyd. ⓘ
Produktion
Im Jahr 1999 wurden jährlich 7000 Tonnen synthetisches und 100 Tonnen natürliches Benzaldehyd hergestellt. Die Chlorierung in der Flüssigphase und die Oxidation von Toluol sind die wichtigsten Verfahren. Es wurden zahlreiche weitere Verfahren entwickelt, wie die partielle Oxidation von Benzylalkohol, die Alkalihydrolyse von Benzalchlorid und die Carbonylierung von Benzol. ⓘ
Eine beträchtliche Menge an natürlichem Benzaldehyd wird aus Zimtaldehyd, das aus Cassiaöl gewonnen wird, durch die Retro-Aldol-Reaktion hergestellt: Das Zimtaldehyd wird in einer wässrig-alkoholischen Lösung mit einer Base (meist Natriumcarbonat oder -bicarbonat) 5 bis 80 Stunden lang auf 90 °C bis 150 °C erhitzt und das gebildete Benzaldehyd anschließend destilliert. Bei dieser Reaktion wird auch Acetaldehyd gewonnen. Der natürliche Status des auf diese Weise gewonnenen Benzaldehyds ist umstritten. Einige andere Lebensmittel werden unbestreitbar stärkeren Reaktionsbedingungen unterworfen, wie z. B. Masa-Mehl, das durch Behandlung von Maismehl mit Natriumhydroxid (Lauge) hergestellt wird. Beim Kochen werden Lebensmittel oft durch katalytische Oxidationsbedingungen verändert, die sogar eine gewisse (wenn auch unbedeutende) Toxizität bewirken können. Wenn Zimtaldehyd der Retro-Aldol-Reaktion unterzogen wird, handelt es sich jedoch zweifellos um eine chemische Umwandlung in eine ganz andere Chemikalie. ⓘ
Die "ortsspezifische Kernspinresonanzspektroskopie", bei der das 1H/2H-Isotopenverhältnis ausgewertet wird, wurde zur Unterscheidung zwischen natürlich vorkommendem und synthetischem Benzaldehyd eingesetzt. ⓘ
Vorkommen
Benzaldehyd und ähnliche Chemikalien kommen natürlich in vielen Lebensmitteln vor. Der größte Teil des Benzaldehyds, den die Menschen zu sich nehmen, stammt aus natürlichen pflanzlichen Lebensmitteln, wie z. B. Mandeln. ⓘ
Mandeln, Aprikosen, Äpfel und Kirschkerne enthalten erhebliche Mengen an Amygdalin. Dieses Glykosid zerfällt unter Enzymkatalyse in Benzaldehyd, Blausäure und zwei Äquivalente Glukose.
Benzaldehyd trägt zum Duft von Austernpilzen (Pleurotus ostreatus) bei. ⓘ
Reaktionen
- Benzaldehyd C6H5–CHO wird leicht zu Benzoesäure C6H5–COOH oxidiert. Diese Reaktion erfolgt – wenn auch sehr langsam – auch bei Raumtemperatur und mit Luftsauerstoff (Autoxidation), so dass Benzaldehyd oft mit Benzoesäure verunreinigt ist (bei größeren Mengen als weißer Feststoff im flüssigen Aldehyd). Als Zwischenstufe wird hierbei Peroxybenzoesäure gebildet.
- Benzaldehyd geht für Aldehyde typische Reaktionen ein, die auch zum Nachweis geeignet sind. Er reagiert beispielsweise mit Hydrazin H2N–NH2 und seinen Derivaten (beispielsweise mit Phenylhydrazin C6H5–NH–NH2 unter Bildung eines Phenylhydrazons).
- Die für die Aromaten typische elektrophile Substitution ist beim Benzaldehyd ebenfalls möglich. Bei der Nitrierung müssen die Reaktionsbedingungen sorgfältig gewählt werden, da die Oxidation zu Benzoesäure als Nebenreaktion auftritt. Aus diesem Grund liegt die Ausbeute an Nitrobenzaldehyd meist unter 50 %.
- Benzoin-Addition: Zwei Moleküle Benzaldehyd können sich in Gegenwart von Cyanid als Katalysator zu Benzoin vereinigen. Allgemein versteht man unter der Benzoin-Addition die entsprechende Reaktion aromatischer Aldehyde (mit Benzaldehyd als einfachstem Vertreter).
- Aldol-Kondensation: Darunter versteht man allgemein die Addition von Carbonylen an Aldehyden. So lässt sich zum Beispiel Dibenzalaceton darstellen. Dabei reagiert ein Keton (Aceton) erst einmal allgemein im basischen zu einer sog. Methylenkomponente. Dieses reagiert nach Zugabe von Benzaldehyd (Carbonylkomponente) zu Benzalaceton (Benzylidenaceton). Führt man eine weitere Addition durch Benzaldehyd durch, so reagiert das Benzalaceton diesmal zur Methylenkomponente im basischen Milieu. Durch die Zweitaddition oder auch doppelte Aldolkondensation sind komplexe Moleküle synthetisierbar, wie beispielsweise das Dibenzalaceton (1,5-Diphenylpenta-1,4-dien-3-on).
- Bei der Hydrat-Bildung findet eine Addition von Wasser an die Aldehydgruppe der Carbonylverbindung unter nukleophilem Angriff statt. Ein Nachteil dieser Reaktion ist die Instabilität von Hydraten allgemein.
- Bei der Reaktion mit primären Aminen (R–NH2) bilden sich ebenfalls unter nukleophilem Angriff am zentralen C-Atom der Carbonylgruppe und nachfolgender Abspaltung von Wasser (Kondensation) aus dem Zwischenprodukt ein Azomethin. ⓘ
Verwendungen
Benzaldehyd wird häufig verwendet, um Lebensmitteln und parfümierten Produkten ein Mandelaroma zu verleihen. Manchmal wird es auch in Kosmetikprodukten verwendet. ⓘ
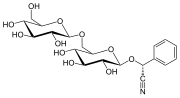
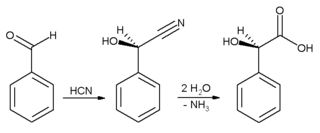
In der Industrie wird Benzaldehyd vor allem als Vorprodukt für andere organische Verbindungen verwendet, von Arzneimitteln bis hin zu Kunststoffadditiven. Der Anilinfarbstoff Malachitgrün wird aus Benzaldehyd und Dimethylanilin hergestellt. Benzaldehyd ist auch ein Vorprodukt für bestimmte Acridinfarbstoffe. Über Aldolkondensationen wird Benzaldehyd in Derivate von Zimtaldehyd und Styrol umgewandelt. Die Synthese von Mandelsäure beginnt mit der Addition von Blausäure an Benzaldehyd:
Das resultierende Cyanhydrin wird zu Mandelsäure hydrolysiert. (Im obigen Schema ist nur eines der beiden gebildeten Enantiomere dargestellt). ⓘ
Nischenanwendungen
Benzaldehyd wird als Bienenabwehrmittel verwendet. Eine kleine Menge Benzaldehydlösung wird auf einem Abzug in der Nähe der Bienenwaben platziert. Die Bienen entfernen sich daraufhin von den Waben, um die Dämpfe zu vermeiden. Der Imker kann dann die Honigrahmen mit geringerem Risiko für Bienen und Imker aus dem Bienenstock nehmen. ⓘ
Sicherheit
Benzaldehyd, das in Lebensmitteln, Kosmetika, Arzneimitteln und Seife verwendet wird, wird von der US-amerikanischen Gesundheitsbehörde FDA und der FEMA als "allgemein sicher" (GRAS) eingestuft. Dieser Status wurde nach einer Überprüfung im Jahr 2005 erneut bekräftigt. In der Europäischen Union ist es als Aromastoff zugelassen. Toxikologische Studien weisen darauf hin, dass es in den für Lebensmittel und Kosmetika verwendeten Konzentrationen sicher und nicht krebserregend ist und sogar antikarzinogene (krebshemmende) Eigenschaften haben kann. ⓘ
Für einen 70 kg schweren Menschen wird die tödliche Dosis auf 50 mL geschätzt. Die United States Environmental Protection Agency hat für Benzaldehyd eine zulässige Tagesdosis von 15 mg/Tag festgelegt. Benzaldehyd reichert sich nicht im menschlichen Gewebe an. Es wird metabolisiert und dann mit dem Urin ausgeschieden. ⓘ
Eigenschaften
Benzaldehyd ist gesundheitsschädlich, wobei eine echte Gesundheitsgefährdung für gewöhnlich nur bei vergleichsweise großen aufgenommenen Mengen zu erwarten ist. Er riecht angenehm süßlich nach Marzipan. Der Geschmack des Benzaldehyds wird allgemein als charakteristisch marzipanartig, jedoch im Reinzustand auch als unangenehm brennend empfunden. In großer Verdünnung, hierbei vor allem mit Ethanol, tritt in zunehmendem Maße eine Wildkirschnote zum Aroma hinzu. Benzaldehyd gehört auch zu den Aromen im Wein. Mit einem Geruchsschwellenwert von 3 Milligramm/l in Weißwein ist es eine wichtige Komponente des Wein-Bouquets. Benzaldehyd besitzt einen Flammpunkt von 64 °C und eine Zündtemperatur von 190 °C. Das Aroma von Marzipan ergibt sich zum größten Teil aus Aromen der verwendeten Mandeln bzw. deren Röstaromen. Ein wichtiger Bestandteil des Aromas ist Benzaldehyd. ⓘ
Verwendung
Benzaldehyd wird als Aromastoff für eine Bittermandelnote verwendet und ist Ausgangsstoff zur Herstellung einer Reihe anderer aromatischer Geruchs- und Geschmacksstoffe. ⓘ
Sicherheitshinweise
Benzaldehyd wurde 2016 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Benzaldehyd waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern und weit verbreiteter Verwendung sowie der möglichen Gefahr durch mutagene Eigenschaften. Die Neubewertung soll ab 2020 von Frankreich durchgeführt werden. ⓘ