Durchflusszytometrie
 Ein Durchflusszytometerröhrchen mit Ansaugstrohhalm | |
| Klassifizierung | Zytometrie |
|---|---|
| Analyten | Zellen oder Partikel |
| Andere Techniken | |
| Zugehörige | Coulter-Zähler |
Die Durchflusszytometrie (FC) ist eine Technik zum Nachweis und zur Messung physikalischer und chemischer Merkmale einer Population von Zellen oder Partikeln. ⓘ
Bei diesem Verfahren wird eine Probe, die Zellen oder Partikel enthält, in einer Flüssigkeit suspendiert und in das Durchflusszytometergerät injiziert. Die Probe wird so fokussiert, dass idealerweise eine Zelle nach der anderen durch einen Laserstrahl fließt, wobei das gestreute Licht charakteristisch für die Zellen und ihre Bestandteile ist. Die Zellen sind häufig mit fluoreszierenden Markern gekennzeichnet, so dass das Licht absorbiert und dann in einem bestimmten Wellenlängenbereich emittiert wird. Zehntausende von Zellen können schnell untersucht werden, und die gesammelten Daten werden von einem Computer verarbeitet. ⓘ
Die Durchflusszytometrie wird routinemäßig in der Grundlagenforschung, in der klinischen Praxis und bei klinischen Studien eingesetzt. Zu den Einsatzmöglichkeiten der Durchflusszytometrie gehören
- Zellzählung
- Zellsortierung
- Bestimmung von Zelleigenschaften und -funktionen
- Nachweis von Mikroorganismen
- Nachweis von Biomarkern
- Nachweis von Protein-Engineering
- Diagnose von Gesundheitsstörungen wie Blutkrebs ⓘ
Ein Durchflusszytometrie-Analysegerät ist ein Instrument, das quantifizierbare Daten aus einer Probe liefert. Zu den anderen Instrumenten, die die Durchflusszytometrie nutzen, gehören Zellsortierer, die Zellen von Interesse auf der Grundlage ihrer optischen Eigenschaften physisch trennen und dadurch aufreinigen. ⓘ
Der Begriff Durchflusszytometrie (Zytometrie = Zell-Vermessung) beschreibt ein Messverfahren, das in der Biologie und in der Medizin zur Anwendung kommt. Es erlaubt die Analyse von Zellen, die in hoher Geschwindigkeit einzeln an einer elektrischen Spannung oder einem Lichtstrahl vorbeifließen. Je nach Form, Struktur und/oder Färbung der Zellen werden unterschiedliche Effekte erzeugt, aus denen die Eigenschaften der Zelle abgeleitet werden können. ⓘ
Bei einer Form der Durchflusszytometrie werden Fluoreszenz-markierte Zellen je nach Färbung in unterschiedliche Reagenzgefäße sortiert. Entsprechende Geräte werden als flow sorter (auf deutsch: Fluss-Sortierer) oder als FACS (=fluorescence-activated cell sorting) bezeichnet. FACS ist jedoch eine geschützte Handelsmarke eines Geräteherstellers. Manchmal wird der Begriff FACS (=fluorescence-activated cell scanning) mit dieser Bedeutung für Geräte verwendet, die keine Sortierung der Zellen, sondern nur eine Analyse ihrer Eigenschaften durchführen. ⓘ
Geschichte
Das erste auf Impedanz basierende Durchflusszytometriegerät, das das Coulter-Prinzip verwendet, wurde im US-Patent 2,656,508 offengelegt, das 1953 an Wallace H. Coulter erteilt wurde. Mack Fulwyler war der Erfinder des Vorläufers der heutigen Durchflusszytometer - insbesondere des Zellsortierers. Fulwyler entwickelte diesen 1965 mit seiner Veröffentlichung in Science. Das erste fluoreszenzbasierte Durchflusszytometriegerät (ICP 11) wurde 1968 von Wolfgang Göhde von der Universität Münster entwickelt, am 18. Dezember 1968 zum Patent angemeldet und 1968/69 vom deutschen Entwickler und Hersteller Partec über die Phywe AG in Göttingen erstmals kommerzialisiert. Zu dieser Zeit wurden Absorptionsmethoden von anderen Wissenschaftlern noch weitgehend gegenüber Fluoreszenzmethoden bevorzugt. Bald darauf wurden Geräte für die Durchflusszytometrie entwickelt, darunter der Cytofluorograph (1971) von Bio/Physics Systems Inc. (später: Ortho Diagnostics), das PAS 8000 (1973) von Partec, das erste FACS-Gerät (fluoreszenzaktivierte Zellsortierung) von Becton Dickinson (1974), das ICP 22 (1975) von Partec/Phywe und die Epics von Coulter (1977/78). Das erste markierungsfreie Hochfrequenz-Impedanz-Durchflusszytometer auf der Grundlage eines patentierten mikrofluidischen "Lab-on-Chip", Ampha Z30, wurde von Amphasys (2012) vorgestellt. ⓘ
Name der Technologie
Der ursprüngliche Name der fluoreszenzbasierten Durchflusszytometrie-Technologie war "Impulszytophotometrie", basierend auf der ersten Patentanmeldung zur fluoreszenzbasierten Durchflusszytometrie. Auf der 5th American Engineering Foundation Conference on Automated Cytology in Pensacola (Florida) im Jahr 1976 - acht Jahre nach der Einführung des ersten fluoreszenzbasierten Durchflusszytometers (1968) - einigte man sich auf die gemeinsame Verwendung des Begriffs "Durchflusszytometrie", der schnell populär wurde. ⓘ
Durchflusszytometer

Moderne Durchflusszytometer sind in der Lage, viele Tausend Partikel pro Sekunde in "Echtzeit" zu analysieren, und wenn sie als Zellsortierer konfiguriert sind, können sie Partikel mit bestimmten optischen Eigenschaften bei ähnlichen Raten aktiv trennen und isolieren. Ein Durchflusszytometer ähnelt einem Mikroskop, mit dem Unterschied, dass die Durchflusszytometrie anstelle eines Bildes der Zelle eine automatisierte Quantifizierung bestimmter optischer Parameter mit hohem Durchsatz für jede einzelne Zelle liefert. Zur Analyse von festem Gewebe muss zunächst eine Einzelzellsuspension hergestellt werden. ⓘ
Ein Durchflusszytometer besteht aus fünf Hauptkomponenten: einer Durchflusszelle, einem Messsystem, einem Detektor, einem Verstärkungssystem und einem Computer für die Auswertung der Signale. Die Durchflusszelle verfügt über einen Flüssigkeitsstrom (Mantelflüssigkeit), der die Zellen trägt und ausrichtet, so dass sie einzeln durch den Lichtstrahl laufen, um erfasst zu werden. Das Messsystem verwendet üblicherweise Impedanz- (oder Leitfähigkeits-) Messungen und optische Systeme - Lampen (Quecksilber, Xenon); wassergekühlte Hochleistungslaser (Argon, Krypton, Farbstofflaser); luftgekühlte Laser mit geringer Leistung (Argon (488 nm), roter HeNe (633 nm), grüner HeNe, HeCd (UV)); Diodenlaser (blau, grün, rot, violett), die Lichtsignale erzeugen. Der Detektor und das Analog-Digital-Wandlersystem (ADC) wandeln analoge Messungen von vorwärts gestreutem Licht (FSC) und seitlich gestreutem Licht (SSC) sowie farbstoffspezifische Fluoreszenzsignale in digitale Signale um, die von einem Computer verarbeitet werden können. Das Verstärkungssystem kann linear oder logarithmisch sein. ⓘ
Der Prozess der Datenerfassung von Proben mit dem Durchflusszytometer wird als "Erfassung" bezeichnet. Die Erfassung erfolgt über einen Computer, der physisch mit dem Durchflusszytometer verbunden ist, und die Software, die die digitale Schnittstelle zum Zytometer verwaltet. Die Software ist in der Lage, die Parameter (z. B. Spannung, Kompensation) für die zu untersuchende Probe einzustellen, und hilft auch bei der Anzeige der anfänglichen Probeninformationen während der Erfassung der Probendaten, um sicherzustellen, dass die Parameter richtig eingestellt sind. Frühe Durchflusszytometer waren im Allgemeinen experimentelle Geräte, aber technologische Fortschritte haben eine breite Anwendung für eine Vielzahl von klinischen und Forschungszwecken ermöglicht. Aufgrund dieser Entwicklungen hat sich ein beachtlicher Markt für Geräte, Analysesoftware und die bei der Erfassung verwendeten Reagenzien wie fluoreszenzmarkierte Antikörper entwickelt. ⓘ
Moderne Instrumente sind in der Regel mit mehreren Lasern und Fluoreszenzdetektoren ausgestattet. Der derzeitige Rekord für ein kommerzielles Instrument liegt bei zehn Lasern und 30 Fluoreszenzdetektoren. Eine höhere Anzahl von Lasern und Detektoren ermöglicht eine mehrfache Markierung von Antikörpern und eine genauere Identifizierung einer Zielpopulation anhand ihrer phänotypischen Marker. Bestimmte Geräte können sogar digitale Bilder einzelner Zellen aufnehmen, die eine Analyse der Position des Fluoreszenzsignals in oder auf der Oberfläche der Zellen ermöglichen. ⓘ
Das Durchflusszytometer besteht aus ⓘ
Hardware

Das Prinzip der Untersuchung beruht auf der Emission von optischen Signalen seitens der Zelle, wenn diese einen Laserstrahl passiert. Durch einen Hüllstrom fokussiert, tritt die Probe in den Mikrokanal einer hochpräzisen Küvette aus Glas oder Quarz ein, sodass jede Zelle einzeln nacheinander durch den Messbereich eines Laserstrahls geführt wird. Das dabei entstehende Streulicht oder Fluoreszenzsignal wird von einem Detektor ausgewertet. Das Ergebnis sind quantitative Informationen über jede einzelne analysierte Zelle. Durch die Analyse einer großen Anzahl von Zellen innerhalb eines sehr kurzen Zeitintervalls (>1000 Zellen/sec) erhält man schnell repräsentative Informationen über Zell-Populationen. Die Menge des gestreuten Lichts korreliert mit der Größe der Zelle und mit ihrer Komplexität. So streuen Granulozyten, die eine raue Oberfläche und in ihrem Inneren viele Vesikel haben, deutlich mehr Licht als die sehr glatten T-Zellen. Das Vorwärtsstreulicht (FSC = Forward Scatter) ist ein Maß für die Beugung des Lichts im flachen Winkel und hängt vom Volumen der Zelle ab. Das Seitwärtsstreulicht (SSC = Side Scatter) ist ein Maß für die Brechung des Lichts im rechten Winkel, die von der Granularität der Zelle, der Größe und Struktur ihres Zellkerns und der Menge der Vesikel in einer Zelle beeinflusst wird. Mit diesen beiden Parametern lassen sich zum Beispiel die Zellen des Blutes bereits recht gut unterscheiden. ⓘ
Fluidiksystem eines Durchflusszytometers
Um die optischen Eigenschaften von Zellen in einem Durchflusszytometer genau messen zu können, müssen die Zellen gleichmäßig durch das Zentrum des fokussierten Laserstrahls hindurchgehen. Der Zweck des Fluidiksystems besteht darin, die Zellen einzeln durch den Laserstrahl und durch das Gerät zu bewegen. Die Fluidik in einem Durchflusszytometer mit Zellsortierfunktionen nutzt den Strahl auch, um sortierte Zellen in Sammelröhrchen oder Vertiefungen zu befördern. ⓘ
Hydrodynamische Fokussierung
Zur präzisen Positionierung von Zellen in einem Flüssigkeitsstrahl wird in den meisten Zytometern die hydrodynamische Fokussierung verwendet. Die Zellen in Suspension gelangen in das Gerät, das von einer äußeren Mantelflüssigkeit umgeben ist. Der Probenkern wird in der Mitte der Mantelflüssigkeit gehalten. Die Probenzufuhr bzw. die Geschwindigkeit, mit der die Zellen zur Laserabfrage durchfließen, kann durch den Druck der Mantelflüssigkeit auf den Probenkern gesteuert werden. Unter optimalen Bedingungen vermischen sich der zentrale Flüssigkeitsstrom und die Mantelflüssigkeit nicht. ⓘ
Akustisch unterstützte hydrodynamische Fokussierung
Die akustische Fokussierungstechnologie wird in einigen Durchflusszytometern zur Unterstützung der hydrodynamischen Fokussierung eingesetzt. Akustische Wellen (>2 MHz) fokussieren die Probe vor, bevor sie in die Hüllflüssigkeit eingebracht wird. Die vorfokussierte Probe wird dann in den hydrodynamischen Kern injiziert und durch das Gerät geleitet. Dies kann dazu beitragen, die Datengenauigkeit bei hohem Probenaufkommen zu erhöhen. ⓘ
Optik und Elektronik
Optische Filter
Das von Fluorophoren emittierte Licht liegt in einem Spektrum von Wellenlängen, so dass die Kombination mehrerer Fluorophore zu Überschneidungen führen kann. Um die Spezifität zu erhöhen, werden optische Filter und dichroitische Spiegel verwendet, um das Licht zu filtern und zu den Detektoren wie Photomultiplier-Röhren (PMTs) oder Avalanche-Photodioden (APDs) zu leiten. Optische Filter werden als Bandpass- (BP), Langpass- (LP) oder Kurzpassfilter (SP) ausgeführt. Die meisten Durchflusszytometer verwenden dichroitische Spiegel und Bandpassfilter, um bestimmte Bereiche des optischen Spektrums auszuwählen. ⓘ
Prismen, Gitter und spektrale Durchflusszytometrie
Bei der spektralen Durchflusszytometrie werden Prismen oder Beugungsgitter verwendet, um das von einem Marker emittierte Licht über eine Detektoranordnung zu streuen. Dadurch können die vollständigen Spektren jedes Partikels gemessen werden. Die gemessenen Spektren einzelner Zellen werden anschließend anhand der Referenzspektren aller verwendeten Farbstoffe und des Autofluoreszenzspektrums vermischt. Dies kann ein breiteres Panel-Design und die Anwendung neuer biologischer Marker ermöglichen. ⓘ
Bildgebende Durchflusszytometrie
Die bildgebende Durchflusszytometrie (IFC) nimmt Mehrkanalbilder von Zellen auf. Die in den Bildgebungsplattformen verwendeten Detektoren können mit ladungsgekoppelten Geräten (CCD) oder komplementären Metall-Oxid-Halbleitern (CMOS) ausgestattet sein, um Bilder von einzelnen Zellen zu erfassen. ⓘ
Auswertung der Daten
Kompensation
Jedes Fluorochrom hat ein breites Fluoreszenzspektrum. Wenn mehr als ein Fluorochrom verwendet wird, kann es zu Überschneidungen zwischen den Fluorochromen kommen. Diese Situation wird als Spektrumüberlappung bezeichnet. Diese Situation muss überwunden werden. Das Emissionsspektrum von FITC und PE besteht beispielsweise darin, dass sich das vom Fluorescein emittierte Licht beim Durchgang durch den für PE verwendeten Filter mit derselben Wellenlänge überschneidet. Diese spektrale Überlappung wird korrigiert, indem ein Teil des FITC-Signals aus den PE-Signalen entfernt wird oder umgekehrt. Dieser Vorgang wird als Farbkompensation bezeichnet, bei der ein Fluorochrom als Prozentsatz berechnet wird, um sich selbst zu messen. ⓘ
Die Kompensation ist der mathematische Prozess, mit dem die spektrale Überlappung von Multiparameter-Durchflusszytometriedaten korrigiert wird. Da Fluorochrome ein breites Spektrum haben können, kann es zu Überschneidungen kommen, die bei der Analyse der Daten zu Verwirrung führen. Diese Überlappung, die als Spillover bezeichnet und im Spillover-Koeffizienten quantifiziert wird, wird in der Regel dadurch verursacht, dass die Detektoren für ein bestimmtes Fluorochrom einen signifikanten Peak in der Wellenlänge eines anderen Fluorochroms messen. Für diese Korrektur wird meist lineare Algebra verwendet. ⓘ
Wenn Diagramme für einen oder mehrere Parameter angezeigt werden, soll damit im Allgemeinen gezeigt werden, dass die anderen Parameter nicht zu der dargestellten Verteilung beitragen. Vor allem bei der Verwendung von Parametern, die mehr als doppelt so groß sind, ist dieses Problem noch gravierender. Derzeit gibt es noch keine Werkzeuge, mit denen sich mehrdimensionale Parameter effizient darstellen lassen. Die Kompensation ist sehr wichtig, um den Unterschied zwischen den Zellen zu erkennen. ⓘ
Gating
Die von Durchflusszytometern erzeugten Daten können in einer einzigen Dimension als Histogramm, in zweidimensionalen Punktdiagrammen oder sogar in drei Dimensionen aufgetragen werden. Die Regionen in diesen Diagrammen können nacheinander auf der Grundlage der Fluoreszenzintensität getrennt werden, indem eine Reihe von Teilmengenextraktionen, die so genannten "Gates", erstellt werden. Für diagnostische und klinische Zwecke, insbesondere im Zusammenhang mit der Hämatologie, gibt es spezielle Gating-Protokolle. Einzelne Zellen werden oft von Zelldoubletten oder höheren Aggregaten durch ihre "Flugzeit" (auch als "Pulsbreite" bezeichnet) durch den eng fokussierten Laserstrahl unterschieden ⓘ
Die Diagramme werden oft auf logarithmischen Skalen erstellt. Da sich die Emissionsspektren verschiedener Fluoreszenzfarbstoffe überschneiden, müssen die Signale an den Detektoren sowohl elektronisch als auch rechnerisch kompensiert werden. Die mit dem Durchflusszytometer gesammelten Daten können mit einer Software analysiert werden. Sobald die Daten erfasst sind, müssen sie nicht mehr an das Durchflusszytometer angeschlossen werden, und die Analyse wird meist auf einem separaten Computer durchgeführt. Dies ist vor allem in zentralen Einrichtungen notwendig, in denen die Nutzung dieser Geräte sehr gefragt ist. ⓘ
Computergestützte Analyse
Jüngste Fortschritte bei der automatischen Identifizierung von Populationen mit Hilfe von Computermethoden bieten eine Alternative zu den herkömmlichen Gating-Strategien. Automatisierte Identifizierungssysteme könnten die Entdeckung seltener und versteckter Populationen erleichtern. Zu den repräsentativen automatisierten Methoden gehören FLOCK im Immunology Database and Analysis Portal (ImmPort), SamSPECTRAL und flowClust in Bioconductor und FLAME in GenePattern. T-Distributed Stochastic Neighbor Embedding (tSNE) ist ein Algorithmus zur Dimensionalitätsreduktion, der die Visualisierung komplexer mehrdimensionaler Daten in einer zweidimensionalen "Karte" ermöglicht. Gemeinsame Bemühungen haben zu einem offenen Projekt namens FlowCAP (Flow Cytometry: Critical Assessment of Population Identification Methods) geführt, das einen objektiven Weg zum Vergleich und zur Bewertung von Clustering-Methoden für Durchflusszytometriedaten bietet und außerdem Leitlinien für den angemessenen Einsatz und die Anwendung dieser Methoden aufstellt. ⓘ
FMO-Kontrollen
Fluoreszenz-Minus-Eins-Kontrollen (FMO) sind wichtig für die Dateninterpretation bei der Erstellung von Mehrfarben-Panels, bei denen eine Zelle mit mehreren Fluorochromen gleichzeitig gefärbt wird. FMO-Kontrollen liefern ein Maß für den Fluoreszenz-Spillover in einem bestimmten Kanal und ermöglichen eine Kompensation. Um eine FMO-Kontrolle zu erstellen, wird eine Probe mit allen Fluorochromen angefärbt, mit Ausnahme des zu testenden Fluorochroms - das heißt, wenn Sie 4 verschiedene Fluorochrome verwenden, darf Ihre FMO-Kontrolle nur 3 davon enthalten (Beispiel: Fluorochrome - A, B, C, D; FMOs - ABC_, AB_D, A_CD, _BCD). ⓘ
Zellsortierung durch Durchflusszytometrie
Zellsortierung ist eine Methode zur Reinigung von Zellpopulationen auf der Grundlage des Vorhandenseins oder Fehlens bestimmter physikalischer Merkmale. In Durchflusszytometern mit Sortierfunktion erkennt das Gerät Zellen anhand von Parametern wie Zellgröße, Morphologie und Proteinexpression. Anschließend werden die Zellen mit Hilfe der Tröpfchentechnologie sortiert und die Untergruppen für die Verwendung nach dem Experiment gewonnen. ⓘ
Der erste Prototyp des Sortierers wurde 1965 am Los Alamos National Laboratory (LANL) von dem Physiker Mack J. Fulwyler gebaut, indem er einen Coulter-Volumensensor mit dem neu erfundenen Tintenstrahldrucker verband. Der Live Cell Cell Sorter oder fluoreszenzaktivierte Zellsortierer (FACS) wurde von Len Herzenberg entwickelt, der 2006 für seine bahnbrechende Arbeit mit dem Kyoto-Preis ausgezeichnet wurde. ⓘ
Durchflusszytometrische Zellsortierer verfügen im Gegensatz zu Durchflusszytometrie-Analysegeräten über ein Sammelsystem. Der Sammelprozess beginnt mit der Injektion einer Probe in einen Strom von Hüllflüssigkeit, der durch die Durchflusszelle fließt und vom Laser abgefangen wird. Der Strom trägt die Zelle dann durch eine vibrierende Düse, die Tröpfchen erzeugt, von denen die meisten entweder eine Zelle oder keine Zellen enthalten. Unmittelbar vor der Messung der Fluoreszenzintensität wird ein elektrischer Aufladungsring an der Stelle platziert, an der der Strom in Tröpfchen zerfällt, und eine Ladung auf dem Ring platziert. Die geladenen Tröpfchen fallen dann durch ein elektrostatisches Ablenksystem, das die Tröpfchen entsprechend ihrer Ladung in Behälter umleitet. Bei einigen Systemen wird die Ladung direkt auf den Strahl aufgebracht, und das abbrechende Tröpfchen behält eine Ladung mit demselben Vorzeichen wie der Strahl. Der Strom wird dann nach dem Abreißen des Tropfens wieder neutralisiert. Nach dem Sammeln können diese Zellen weiter kultiviert, manipuliert und untersucht werden. ⓘ

Ein FACS-Gerät besitzt nach den Fluoreszenzdetektoren zusätzlich einen Vibrator zur Unterteilung des Flüssigkeitsstroms in kleine Tröpfchen ("hydrodynamische Fokussierung" beschreibt das Erreichen eines dünneren Probenstrahls bzw. Probenstroms innerhalb der Fließzelle durch den Hüllstrom.) und einen elektrostatischen Sortiermechanismus. Die Tröpfchengröße ist so gewählt, dass nur wenig mehr als eine Zelle hineinpasst, was zu einer Vereinzelung führt. An der Elektrode des Sortiermechanismus wird der Tropfen bei einer zu sortierenden Zelle umgekehrt polarisiert und fällt durch ein elektrisches Feld in ein anderes Gefäß als nicht zu sortierende Zellen (in der nebenstehenden Abbildung wird fälschlicherweise ein magnetisches Feld/Elektromagnet dargestellt. Das sollte korrigiert werden). Der Begriff FACS ist ein eingetragenes Warenzeichen von Becton Dickinson, wird jedoch als generischer Begriff für alle Zellsortierungen anhand einer Fluoreszenz verwendet. Der Vorläufer des FACS sortierte anhand bestimmter Impedanzänderungen und wurde 1965 von Mack Jett Fulwyler bei Beckman Coulter entwickelt. Das FACS wurde 1969 von Leonard A. Herzenberg entwickelt, der dafür 2006 den Kyoto-Preis erhielt. ⓘ
Etiketten
Die Durchflusszytometrie nutzt die Lichteigenschaften, die von Zellen oder Partikeln gestreut werden, zur Identifizierung oder quantitativen Messung von physikalischen Eigenschaften. Marker, Farbstoffe und Färbemittel können für die multiparametrische Analyse verwendet werden (um mehr Eigenschaften einer Zelle zu verstehen). Immunphänotypisierung ist die Analyse heterogener Zellpopulationen unter Verwendung markierter Antikörper und anderer fluorophorhaltiger Reagenzien wie Farbstoffe und Färbemittel. ⓘ
Fluoreszierende Markierungen
In der Durchflusszytometrie kann eine breite Palette von Fluorophoren als Marker verwendet werden. Fluorophore, oder einfach "Fluore", sind in der Regel an einen Antikörper gebunden, der ein Zielmerkmal auf oder in der Zelle erkennt; sie können auch an eine chemische Einheit mit Affinität für die Zellmembran oder eine andere zelluläre Struktur gebunden sein. Jedes Fluorophor hat eine charakteristische Spitzenanregungs- und -emissionswellenlänge, und die Emissionsspektren überschneiden sich häufig. Folglich hängt die Kombination von Markern, die verwendet werden kann, von der Wellenlänge der Lampe(n) oder des Lasers/der Laser, die zur Anregung der Fluorochrome verwendet werden, und von den verfügbaren Detektoren ab. Man geht davon aus, dass die maximale Anzahl unterscheidbarer Fluoreszenzmarker bei 17 oder 18 liegt, und dieses Maß an Komplexität erfordert eine aufwändige Optimierung zur Begrenzung von Artefakten sowie komplexe Entfaltungsalgorithmen zur Trennung überlappender Spektren. Bei der Durchflusszytometrie wird die Fluoreszenz als quantitatives Werkzeug eingesetzt; die höchste Empfindlichkeit der Durchflusszytometrie wird von anderen Fluoreszenznachweisplattformen wie der konfokalen Mikroskopie nicht erreicht. Die absolute Fluoreszenzempfindlichkeit ist bei der konfokalen Mikroskopie in der Regel geringer, weil unscharfe Signale vom konfokalen optischen System zurückgewiesen werden und weil das Bild seriell aus Einzelmessungen an jeder Stelle der Zelle aufgebaut wird, wodurch die für die Signalerfassung zur Verfügung stehende Zeit verkürzt wird. ⓘ
Quantenpunkte
Quantenpunkte werden manchmal anstelle von herkömmlichen Fluorophoren verwendet, da sie schmalere Emissionsspitzen aufweisen. ⓘ
Isotopenmarkierung
Die Massenzytometrie überwindet die Grenzen der Fluoreszenzmarkierung durch den Einsatz von Lanthanid-Isotopen, die an Antikörper gebunden sind. Diese Methode könnte theoretisch die Verwendung von 40 bis 60 unterscheidbaren Markern ermöglichen und wurde bereits für 30 Marker demonstriert. Die Massenzytometrie unterscheidet sich grundlegend von der Durchflusszytometrie: Die Zellen werden in ein Plasma eingebracht, ionisiert und die assoziierten Isotope werden mittels Flugzeit-Massenspektrometrie quantifiziert. Diese Methode erlaubt zwar die Verwendung einer großen Anzahl von Markern, hat aber derzeit eine geringere Durchsatzkapazität als die Durchflusszytometrie. Außerdem werden dabei die analysierten Zellen zerstört, so dass sie nicht durch Sortieren wiedergewonnen werden können. ⓘ
Zytometrischer Bead-Array
Neben der Möglichkeit, einzelne Zellen mit fluoreszierenden Antikörpern zu markieren und zu identifizieren, können auch zelluläre Produkte wie Zytokine, Proteine und andere Faktoren gemessen werden. Ähnlich wie ELISA-Sandwich-Assays verwenden zytometrische Bead-Array-Assays (CBA) mehrere Bead-Populationen, die sich in der Regel durch ihre Größe und unterschiedliche Fluoreszenzintensität unterscheiden, um mehrere Analyten in einem einzigen Assay zu unterscheiden. Die Menge des erfassten Analyten wird mit Hilfe eines biotinylierten Antikörpers gegen ein sekundäres Epitop des Proteins nachgewiesen, gefolgt von einer Streptavidin-R-Phycoerythrin-Behandlung. Die Fluoreszenzintensität von R-Phycoerythrin auf den Beads wird mit einem Durchflusszytometer, das mit einer 488-nm-Anregungsquelle ausgestattet ist, quantifiziert. Die Konzentrationen eines interessierenden Proteins in den Proben können durch Vergleich der Fluoreszenzsignale mit denen einer Standardkurve ermittelt werden, die aus einer seriellen Verdünnung einer bekannten Konzentration des Analyten erstellt wurde. Häufig auch als Cytokine Bead Array (CBA) bezeichnet. ⓘ
Impedanz-Durchflusszytometrie
Auf Impedanz basierende Einzelzellanalysesysteme sind gemeinhin als Coulter-Zähler bekannt. Sie sind eine bewährte Methode zur Zählung und Größenbestimmung praktisch aller Arten von Zellen und Partikeln. Die markierungsfreie Technologie wurde vor kurzem durch einen "Lab-on-a-Chip"-Ansatz und durch die Anwendung von hochfrequentem Wechselstrom (AC) im Radiofrequenzbereich (von 100 kHz bis 30 MHz) anstelle eines statischen Gleichstroms (DC) oder niederfrequenten AC-Feldes verbessert. Diese patentierte Technologie ermöglicht eine hochgenaue Zellanalyse und liefert zusätzliche Informationen wie Membrankapazität und Lebensfähigkeit. Die relativ geringe Größe und die Robustheit ermöglichen den batteriebetriebenen Einsatz im Feld. ⓘ
Messbare Parameter
- Apoptose (Quantifizierung, Messung von DNA-Abbau, mitochondrialem Membranpotenzial, Permeabilitätsänderungen, Caspase-Aktivität)
- Zelladhärenz (z. B. Adhärenz zwischen Pathogen und Wirtszelle)
- Zellpigmente wie Chlorophyll oder Phycoerythrin
- Zelloberflächenantigene (Cluster of differentiation (CD)-Marker)
- Lebensfähigkeit der Zellen
- Zirkulierende Tumorzellen: Isolierung und Aufreinigung
- Charakterisierung der Multidrug-Resistenz (MDR) in Krebszellen
- Chromosomenanalyse und -sortierung (Bibliotheksaufbau, Chromosomenfarbe)
- Variation der DNA-Kopienzahl (mittels Flow-FISH oder BACs-on-Beads-Technologie)
- Enzymatische Aktivität
- Glutathion
- Intrazelluläre Antigene (verschiedene Zytokine, sekundäre Mediatoren, usw.)
- Fluidität der Membranen
- Überwachung der Elektropermeabilisierung von Zellen
- Nukleare Antigene
- Oxidativer Ausbruch
- pH-Wert, intrazelluläres ionisiertes Kalzium, Magnesium, Membranpotential
- Proteinexpression und -lokalisierung
- Proteinveränderungen, Phospho-Proteine
- Die Lichtstreuung kann zur Messung des Volumens (durch Vorwärtsstreuung) und der morphologischen Komplexität (durch Seitenstreuung) von Zellen oder anderen Partikeln, auch solchen, die nicht fluoreszieren, verwendet werden. Diese werden üblicherweise als FSC bzw. SSC abgekürzt.
- Gesamt-DNA-Gehalt (Zellzyklusanalyse, Zellkinetik, Proliferation, Ploidie, Aneuploidie, Endoreduplikation usw.)
- Gesamt-RNA-Gehalt
- Transgene Produkte in vivo, insbesondere das grün fluoreszierende Protein oder verwandte fluoreszierende Proteine
- Verschiedene Kombinationen (DNA/Oberflächenantigene, usw.) ⓘ
Anwendungen
Die Technologie findet in einer Reihe von Bereichen Anwendung, darunter Molekularbiologie, Pathologie, Immunologie, Virologie, Pflanzenbiologie und Meeresbiologie. Sie findet breite Anwendung in der Medizin, insbesondere in der Transplantation, Hämatologie, Tumorimmunologie und Chemotherapie, Pränataldiagnose, Genetik und Spermasortierung zur Geschlechtsvorauswahl. Die Durchflusszytometrie wird in großem Umfang eingesetzt, um Anomalien der Samenzellen im Zusammenhang mit der DNA-Fragmentierung bei Fruchtbarkeitstests für Männer festzustellen. Auch in der Forschung wird sie häufig zum Nachweis von DNA-Schäden, Caspase-Spaltung und Apoptose eingesetzt. Die photoakustische Durchflusszytometrie wird bei der Untersuchung von multiresistenten Bakterien (vor allem MRSA) eingesetzt, um mit gefärbten Bakteriophagen markierte Bakterien im Blut zu erkennen, zu differenzieren und zu quantifizieren. In den Neurowissenschaften kann auch die Koexpression von Zelloberflächen- und intrazellulären Antigenen analysiert werden. In der Mikrobiologie kann die Durchflusszytometrie zum Screening und zur Sortierung von Transposon-Mutantenbibliotheken verwendet werden, die mit einem GFP-kodierenden Transposon (TnMHA) erstellt wurden, oder zur Bewertung der Lebensfähigkeit. Beim Protein-Engineering wird die Durchflusszytometrie in Verbindung mit dem Hefe-Display und dem bakteriellen Display eingesetzt, um an der Zelloberfläche dargestellte Proteinvarianten mit den gewünschten Eigenschaften zu identifizieren. Der Hauptvorteil der Durchflusszytometrie gegenüber der Histologie und der IHC besteht in der Möglichkeit, die Menge der Antigene genau zu messen und jede Zelle mit mehreren Antikörper-Fluorophoren zu färben; in den derzeitigen Labors können etwa 10 Antikörper an jede Zelle gebunden werden. Das ist viel weniger als bei Massenzytometern, wo derzeit bis zu 40 gemessen werden können, allerdings zu einem höheren Preis und in einem langsameren Tempo. ⓘ
Die Durchflusszytometrie wird in der Klinik für die Routinediagnostik unter anderem in der Hämatologie, Infektiologie und Immunologie eingesetzt. Ein weiteres großes Einsatzgebiet stellt die medizinische und zellbiologische Grundlagenforschung dar. Außerdem wird dieses Verfahren auch in der Biotechnologie verwendet, z. B. um Spermazellen mit dem Geschlechtschromosom X und solche mit dem Chromosom Y voneinander zu trennen (wobei dazu auch die Dichtegradientenzentrifugation geeignet ist). Somit kann man das Geschlecht eines durch In-vitro-Fertilisation erzeugten Embryos bestimmen, indem vor der In-vitro-Fertilisation die Spermien mit einem X und einem Y-Chromosom getrennt werden. ⓘ
Eine weitere Anwendung ist in der Biologie die quantitative Untersuchung von Zellen. Neben der einfachen Bestimmung der Zellzahlen können durch Anfärben der Zellen zumeist mit dem fluoreszierenden DNA-Farbstoff SYBR Green I im Zuge einer Zellviabilitätsbestimmung lebende von toten Zellen unterschieden werden. Propidiumiodid gelangt nur in Zellen mit nicht mehr intakter Zellmembran und färbt somit nur tote Zellen. In Kombination mit einem DNA-Farbstoff kann der Anteil der toten Zellen von der Gesamtzellzahl bestimmt werden. Außerdem können Zellfunktionen (wie z. B. Phagozytose, reaktive Sauerstoffspezies, LE-Zell-Test) mit Hilfe der Durchflusszytometrie analysiert werden. ⓘ
Ende 2012 ist die Durchflusszytometrie als empfohlene Methode zur Bestimmung der Totalzellzahl in Süßwasser in das Schweizerische Lebensmittelbuch aufgenommen worden. ⓘ
Aquatische Forschung
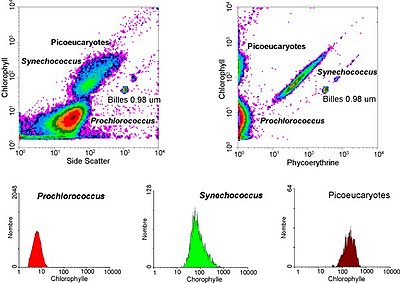
In aquatischen Systemen wird die Durchflusszytometrie für die Analyse von autofluoreszierenden Zellen oder von Zellen, die mit zusätzlichen Farbstoffen fluoreszierend markiert sind, eingesetzt. Diese Forschung begann 1981, als Clarice Yentsch die Durchflusszytometrie nutzte, um die Fluoreszenz in einem Dinoflagellaten zu messen, der rote Flut produziert. Im folgenden Jahr veröffentlichten Forscher durchflusszytometrische Messungen mehrerer Algenarten, die anhand ihrer Fluoreszenzmerkmale unterschieden werden konnten. 1983 bauten Meeresforscher ihre eigenen Durchflusszytometer zusammen oder verwendeten kommerziell erhältliche Durchflusszytometer für Meerwasserproben, die sie vor den Bermudas entnommen hatten, um nachzuweisen, dass Phytoplanktonzellen von nicht lebendem Material unterschieden und Cyanobakterien aus einer gemischten Gemeinschaft aussortiert und anschließend im Labor gezüchtet werden konnten. Die Durchflusszytometrie ermöglichte es den Meeresforschern auch, zwischen schwach fluoreszierenden Prochlorokokken und heterotrophen Mikroorganismen zu unterscheiden, eine Unterscheidung, die bei mikroskopischen Untersuchungen schwierig ist. Dank des technischen Fortschritts können Meeresforscher heute Durchflusszytometer während ihrer Forschungsreisen kontinuierlich einsetzen, und Durchflusszytometer werden verwendet, um Bilder einzelner Phytoplanktonzellen zu erstellen. Meereswissenschaftler nutzen die Sortierfähigkeit von Durchflusszytometern, um diskrete Messungen der Zellaktivität und -vielfalt vorzunehmen, Untersuchungen zu den wechselseitigen Beziehungen zwischen Mikroorganismen, die in unmittelbarer Nähe leben, durchzuführen und die biogeochemischen Raten verschiedener Prozesse im Ozean zu messen. ⓘ
Assay zur Zellproliferation
Die Zellproliferation ist die wichtigste Funktion des Immunsystems. Oft ist es erforderlich, die Vermehrung der Zellen zu analysieren, um bestimmte Schlussfolgerungen ziehen zu können. Ein solcher Test zur Bestimmung der Zellproliferation ist der Tracking-Farbstoff Carboxyfluorescein-Diacetat-Succinimidyl-Ester (CFSE). Er hilft bei der Überwachung proliferativer Zellen. Dieser Assay liefert sowohl quantitative als auch qualitative Daten bei Zeitreihenexperimenten. Dieser Farbstoff bindet kovalent an die langlebigen Moleküle in der Zelle. Wenn sich die Zellen teilen, teilen sich auch die Moleküle, und die Tochterzellen besitzen die Hälfte des Farbstoffs im Vergleich zur Mutterpopulation. Diese Abnahme der Intensität kann mit der Durchflusszytometrie sichtbar gemacht werden. In der Literatur wurde diese leistungsstarke Technik der Durchflusszytometrie und CFSE verwendet, um die Effizienz von T-Zellen bei der Abtötung von Zielzellen bei Krebs wie Leukämie zu ermitteln. Um den schnellen und langsamen Tod der Zielzellen sichtbar zu machen, haben Wissenschaftler die CFSE-Markierung mit Antikörperfärbung bestimmter Zelltypen und fluoreszenzmarkierten Mikrokügelchen verwendet. Dies gab auch Aufschluss über die Proliferation der Zielzellen bei der Behandlung mit bestimmten Zytokinen. ⓘ
Lebensmittel
In der Lebensmittelanalytik kann die Durchflusszytometrie für die Bestimmung der Keimzahl in Rohmilch eingesetzt werden. In vielen Betrieben wird die zytometrisch bestimmte Lebendkeimzahl auch für die Endproduktkontrolle eingesetzt. Dies gilt insbesondere bei der Warenfreigabe von modernen Varianten wie UHT-Milch oder ESL-Milch, bei der die Haltbarkeit ein besonders wichtiges Qualitätsmerkmal ist. ⓘ
Fluoreszenzmessungen
Zugleich mit dem gestreuten Licht kann man im Durchflusszytometer Fluoreszenzfarben messen. Nur wenige Zellen emittieren per se fluoreszierendes Licht. Daher verwendet man Farbstoffe, die an bestimmte Bestandteile der Zellen binden. Setzt man z. B. die Farbstoffe DAPI und Propidiumiodid ein, welche an die DNA einer Zelle binden (DAPI) bzw. in diese interkalieren (Propidiumiodid) - d. h. sich zwischen die Basen einlagern -, kann man anhand der Helligkeit der Zelle untersuchen, wie viel DNA sie enthält. Auch Antikörper, die mit Fluoreszenzfarbstoffen markiert sind, können verwendet werden. Die Antikörper sind meist gegen bestimmte Oberflächenproteine (z. B. Proteine der CD-Klassifizierung; CD = Cluster of differentiation) gerichtet. Nach Markierung kann dann auch die Sortierung nach diesen Merkmalen erfolgen. Durch Einsatz von verschiedenfarbigen Lasern und vor allem Filtern kann die Anzahl der einsetzbaren Farbstoffe und damit die Informationsdichte erhöht werden. ⓘ
High-Throughput-Screening
Das optische Prinzip des Durchflusszytometers ähnelt sehr stark dem des (Fluoreszenz-) Mikroskops. Im Gegensatz zum Mikroskop kann man im Durchflusszytometer bis zu 10.000 Zellen pro Sekunde typisieren. Die Kontrolle der Messung ist in Echtzeit möglich. ⓘ
Die im Durchflusszytometer gesammelten Daten werden in Graphen dargestellt, in denen ein oder zwei Parameter zugleich betrachtet werden. Eine Teilmenge der Zellen, die innerhalb einer frei wählbaren Region liegen, kann mit Hilfe eines sogenannten „Gates“ für weitere Analysen ausgewählt werden. Durch Sequenzen von sequentiellen Gates können detaillierte Analysen gemacht werden. ⓘ
Darstellung von Durchflusszytometriedaten
Durchflusszytometriedaten werden typischerweise auf zwei Arten dargestellt: Histogramme, die nur einen einzelnen Parameter messen oder vergleichen, und Dotplot, die zwei oder drei Parameter gleichzeitig auf einem zwei- oder dreidimensionalen Streudiagramm vergleichen. Ein Histogramm zeichnet typischerweise die in einem einzigen Kanal erfasste Intensität entlang einer Achse auf. Die Anzahl der bei dieser Intensität erfassten Ereignisse liegt in einer separaten Achse. Eine große Anzahl von Ereignissen, die mit einer bestimmten Intensität erfasst wurden, wird als Spitze auf dem Histogramm angezeigt. Werden zwei oder drei verschiedene Parameter während einer Messung erfasst, reicht ein Histogramm nicht aus. Man bedient sich einer mehrdimensionalen Darstellung – dem Punktdiagramm bzw. Dotplot – um so die Korrelationsverteilung der Parameter zeigen zu können. Anders als im Histogramm wird im Dotplot jedes Ereignis als ein einzelner Punkt auf einem Streudiagramm dargestellt. Die Intensität von zwei verschiedenen Kanälen (oder drei verschiedenen Kanälen in einer dreidimensionalen Darstellung) wird entlang der verschiedenen Achsen dargestellt. ⓘ

