Stammzelle
| Stammzelle ⓘ | |
|---|---|
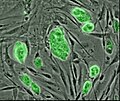
 Transmissionselektronenmikroskopische Aufnahme einer mesenchymalen Stammzelle mit typischen ultrastrukturellen Merkmalen | |
| Einzelheiten | |
| Bezeichner | |
| Lateinisch | Cellula praecursoria |
| Anatomische Terminologie [Bearbeiten auf Wikidata] | |
In mehrzelligen Organismen sind Stammzellen undifferenzierte oder teilweise differenzierte Zellen, die sich in verschiedene Zelltypen differenzieren und sich unbegrenzt vermehren können, um mehr von derselben Stammzelle zu produzieren. Sie sind der früheste Zelltyp eines Zellstamms. Sie kommen sowohl in embryonalen als auch in adulten Organismen vor, weisen aber jeweils leicht unterschiedliche Eigenschaften auf. Man unterscheidet sie in der Regel von Vorläuferzellen, die sich nicht unbegrenzt teilen können, und Vorläufer- oder Blastenzellen, die sich in der Regel auf die Differenzierung in einen Zelltyp festlegen. ⓘ
Bei Säugetieren bilden etwa 50-150 Zellen die innere Zellmasse während des Blastozystenstadiums der Embryonalentwicklung, etwa an den Tagen 5-14. Diese Zellen haben die Fähigkeit zur Stammzellbildung. In vivo differenzieren sie sich schließlich in alle Zelltypen des Körpers (wodurch sie pluripotent werden). Dieser Prozess beginnt mit der Differenzierung in die drei Keimschichten - das Ektoderm, Mesoderm und Endoderm - im Stadium der Gastrulation. Wenn sie jedoch isoliert und in vitro kultiviert werden, können sie im Stammzellstadium gehalten werden und werden als embryonale Stammzellen (ESC) bezeichnet. ⓘ
Adulte Stammzellen befinden sich an einigen wenigen ausgewählten Stellen im Körper, den so genannten Nischen, z. B. im Knochenmark oder in den Keimdrüsen. Sie sind multipotent oder unipotent, d. h. sie differenzieren sich nur in einige wenige Zelltypen oder einen Zelltyp. Bei Säugetieren gehören dazu unter anderem hämatopoetische Stammzellen, die Blut- und Immunzellen nachbilden, Basalzellen, die das Epithel der Haut erhalten, und mesenchymale Stammzellen, die Knochen-, Knorpel-, Muskel- und Fettzellen erhalten. Adulte Stammzellen sind eine kleine Minderheit von Zellen; sie werden von den Vorläuferzellen und den terminal differenzierten Zellen, in die sie sich ausdifferenzieren, bei weitem übertroffen. ⓘ
Die Erforschung von Stammzellen geht auf die Erkenntnisse der kanadischen Biologen Ernest McCulloch, James Till und Andrew J. Becker an der Universität Toronto und dem Ontario Cancer Institute in den 1960er Jahren zurück. Die einzige etablierte medizinische Therapie mit Stammzellen ist seit 2016 die hämatopoetische Stammzelltransplantation, die erstmals 1958 von dem französischen Onkologen Georges Mathé durchgeführt wurde. Seit 1998 ist es jedoch möglich, menschliche embryonale Stammzellen zu kultivieren und zu differenzieren (in Stammzelllinien). Das Verfahren zur Isolierung dieser Zellen ist umstritten, da es in der Regel mit der Zerstörung des Embryos einhergeht. In einigen europäischen Ländern und in Kanada sind die Quellen für die Isolierung von WSZ beschränkt, während andere Länder wie das Vereinigte Königreich und China die Forschung fördern. Der somatische Zellkerntransfer ist eine Klonierungsmethode, mit der ein geklonter Embryo erzeugt werden kann, um seine embryonalen Stammzellen für die Stammzelltherapie zu verwenden. Im Jahr 2006 entdeckte ein japanisches Team unter der Leitung von Shinya Yamanaka eine Methode, um reife Körperzellen wieder in Stammzellen umzuwandeln. Diese wurden als induzierte pluripotente Stammzellen (iPSCs) bezeichnet. ⓘ

Als Stammzellen werden allgemein Körperzellen bezeichnet, die sich in verschiedene Zelltypen oder Gewebe ausdifferenzieren können. Je nach Art der Stammzelle und ihrer Beeinflussung haben sie das Potenzial, sich in jegliches Gewebe (embryonale Stammzellen) oder in bestimmte festgelegte Gewebetypen (adulte Stammzellen) zu entwickeln. ⓘ
Stammzellen sind in der Lage, Tochterzellen zu generieren, die selbst wiederum Stammzelleigenschaften besitzen, aber auch solche mit größerer Ausdifferenzierung. Hierzu befähigt sie ein noch nicht vollständig geklärter Mechanismus asymmetrischer Zellteilung. Über das jeweilige Schicksal der Zellen entscheidet dabei vor allem das biologische Milieu, in dem sie sich befinden. ⓘ
Stammzellen werden vor allem durch ihr ontogenetisches Alter und ihr Differenzierungspotenzial unterschieden: die ontogenetisch frühesten Stammzellen sind die pluripotenten embryonalen Stammzellen, aus denen später die primitiven Keimstammzellen sowie die somatischen Stamm- und Progenitorzellen (oder Vorläuferzellen) hervorgehen. Phylogenetisch gehen die Stammzellen auf den letzten gemeinsamen eukaryotischen Vorfahren (LECA) zurück. ⓘ
Auch Pflanzen besitzen Stammzellen. Diese befinden sich an der Spitze des Sprosses im sogenannten Apikalmeristem sowie an den Wurzelspitzen im Wurzelmeristem. Im Gegensatz zu fast allen tierischen und menschlichen Zellen besitzen bei Pflanzen praktisch alle Zellen die Fähigkeit, einen kompletten Organismus zu regenerieren. ⓘ
Geschichte
Der Begriff Stammzelle wurde von Theodor Boveri und Valentin Haecker im späten 19. Jahrhundert geprägt. Pionierarbeiten zur Theorie der Blutstammzellen wurden Anfang des 20. Jahrhunderts von Artur Pappenheim, Alexander Maximow und Franz Ernst Christian Neumann durchgeführt. ⓘ
Die Schlüsseleigenschaften einer Stammzelle wurden erstmals von Ernest McCulloch und James Till an der Universität Toronto und dem Ontario Cancer Institute in den frühen 1960er Jahren definiert. Sie entdeckten die blutbildende Stammzelle, die hämatopoetische Stammzelle (HSC), durch ihre bahnbrechenden Arbeiten an Mäusen. McCulloch und Till begannen eine Reihe von Experimenten, bei denen Knochenmarkzellen in bestrahlte Mäuse injiziert wurden. Sie beobachteten in der Milz der Mäuse Klumpen, die linear proportional zur Anzahl der injizierten Knochenmarkzellen verliefen. Sie stellten die Hypothese auf, dass es sich bei jedem Knoten (Kolonie) um einen Klon handelt, der aus einer einzigen Knochenmarkzelle (Stammzelle) hervorgegangen ist. In weiteren Arbeiten bestätigten McCulloch und Till gemeinsam mit dem Doktoranden Andrew John Becker und dem leitenden Wissenschaftler Louis Siminovitch, dass jeder Knoten tatsächlich aus einer einzigen Zelle entstanden war. Ihre Ergebnisse wurden 1963 in Nature veröffentlicht. Im selben Jahr war Siminovitch federführend an Studien beteiligt, in denen festgestellt wurde, dass koloniebildende Zellen zur Selbsterneuerung fähig sind - eine der wichtigsten Eigenschaften von Stammzellen, die Till und McCulloch theoretisiert hatten. ⓘ
Die erste Therapie mit Stammzellen war eine Knochenmarktransplantation, die der französische Onkologe Georges Mathé 1958 bei fünf Arbeitern des Vinča-Kernkraftwerks in Jugoslawien durchführte, die von einem Kritikalitätsunfall betroffen waren. Die Arbeiter überlebten alle. ⓘ
1981 wurden von den britischen Biologen Martin Evans und Matthew Kaufman erstmals embryonale Stammzellen (ES) isoliert und erfolgreich in Blastozysten der Maus gezüchtet. Dies ermöglichte die Bildung von genetischen Mäusemodellen, einem System, bei dem die Gene von Mäusen gelöscht oder verändert werden, um ihre Funktion in der Pathologie zu untersuchen. 1998 wurden erstmals embryonale Stammzellen von dem amerikanischen Biologen James Thomson isoliert, was neue Transplantationsmethoden oder verschiedene Zelltypen für die Erprobung neuer Therapien ermöglichte. Im Jahr 2006 verwandelte das Team von Shinya Yamanaka in Kyoto, Japan, Fibroblasten in pluripotente Stammzellen, indem es die Expression von nur vier Genen veränderte. Dieses Kunststück stellt den Ursprung der induzierten pluripotenten Stammzellen dar, die auch als iPS-Zellen bekannt sind. ⓘ
Im Jahr 2011 wurde ein weiblicher Mähnenwolf, der von einem Lastwagen überfahren worden war, im Zoo von Brasília einer Stammzellenbehandlung unterzogen - der erste dokumentierte Fall der Verwendung von Stammzellen zur Heilung von Verletzungen bei einem Wildtier. ⓘ
Eigenschaften
Die klassische Definition einer Stammzelle setzt voraus, dass sie zwei Eigenschaften besitzt:
- Selbsterneuerung: die Fähigkeit, zahlreiche Zyklen des Zellwachstums und der Zellteilung zu durchlaufen, was als Zellproliferation bezeichnet wird, und dabei den undifferenzierten Zustand zu erhalten.
- Potenz: die Fähigkeit, sich in spezialisierte Zelltypen zu differenzieren. Im engeren Sinne setzt dies voraus, dass Stammzellen entweder totipotent oder pluripotent sind, d. h. dass sie in der Lage sind, jeden reifen Zelltyp hervorzubringen, auch wenn multipotente oder unipotente Vorläuferzellen manchmal als Stammzellen bezeichnet werden. Abgesehen davon wird gesagt, dass die Funktion der Stammzellen durch einen Rückkopplungsmechanismus reguliert wird. ⓘ
Selbsterneuerung
Zwei Mechanismen sorgen dafür, dass eine Stammzellpopulation erhalten bleibt (nicht schrumpft): 1. Asymmetrische Zellteilung: Eine Stammzelle teilt sich in eine Mutterzelle, die mit der ursprünglichen Stammzelle identisch ist, und eine Tochterzelle, die differenziert ist. ⓘ
Wenn sich eine Stammzelle selbst erneuert, teilt sie sich, ohne den undifferenzierten Zustand zu unterbrechen. Diese Selbsterneuerung erfordert eine Kontrolle des Zellzyklus sowie die Aufrechterhaltung der Multipotenz oder Pluripotenz, die alle von der Stammzelle abhängen. ⓘ
2. Stochastische Differenzierung: Wenn eine Stammzelle wächst und sich in zwei differenzierte Tochterzellen teilt, durchläuft eine andere Stammzelle eine Mitose und erzeugt zwei mit der ursprünglichen identische Stammzellen. ⓘ
Stammzellen verwenden Telomerase, ein Protein, das die Telomere wiederherstellt, um ihre DNA zu schützen und ihre Zellteilungsgrenze (die Hayflick-Grenze) zu verlängern. ⓘ
Bedeutung der Potenz

A: Stammzellkolonien, die noch nicht differenziert sind.
B: Nervenzellen, ein Beispiel für einen Zelltyp nach der Differenzierung. ⓘ
Die Potenz gibt das Differenzierungspotenzial (das Potenzial, sich in verschiedene Zelltypen zu differenzieren) der Stammzelle an.
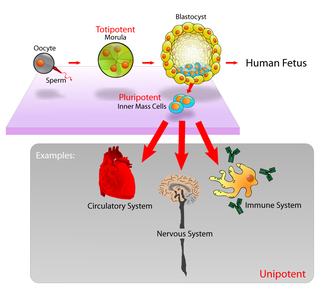
- Totipotente (auch als omnipotente) Stammzellen können sich in embryonale und extraembryonale Zelltypen differenzieren. Solche Zellen können einen vollständigen, lebensfähigen Organismus aufbauen. Diese Zellen entstehen durch die Verschmelzung einer Ei- und einer Samenzelle. Zellen, die aus den ersten Teilungen einer befruchteten Eizelle hervorgehen, sind ebenfalls totipotent.
- Pluripotente Stammzellen sind die Nachkommen totipotenter Zellen und können sich in fast alle Zellen differenzieren, d. h. in Zellen, die aus jeder der drei Keimschichten stammen.
- Multipotente Stammzellen können sich in eine Reihe von Zelltypen differenzieren, jedoch nur in solche einer eng verwandten Zellfamilie.
- Oligopotente Stammzellen können sich nur in einige wenige Zelltypen differenzieren, z. B. in lymphoide oder myeloische Stammzellen.
- Unipotente Zellen können nur einen Zelltyp, nämlich ihren eigenen, produzieren, haben aber die Eigenschaft der Selbsterneuerung, was sie von Nicht-Stammzellen unterscheidet. ⓘ
Identifizierung
In der Praxis werden Stammzellen daran erkannt, ob sie Gewebe regenerieren können. Der entscheidende Test für Knochenmark oder hämatopoetische Stammzellen (HSCs) ist beispielsweise die Fähigkeit, die Zellen zu transplantieren und ein Individuum ohne HSCs zu retten. Dies beweist, dass die Zellen langfristig neue Blutzellen produzieren können. Es sollte auch möglich sein, aus dem transplantierten Individuum Stammzellen zu isolieren, die ihrerseits in ein anderes Individuum ohne HSZ transplantiert werden können, was beweist, dass die Stammzelle in der Lage war, sich selbst zu erneuern. ⓘ
Die Eigenschaften von Stammzellen lassen sich in vitro mit Methoden wie dem Klonogenitätstest veranschaulichen, bei dem einzelne Zellen auf ihre Fähigkeit zur Differenzierung und Selbsterneuerung untersucht werden. Stammzellen können auch durch den Besitz einer Reihe von Zelloberflächenmarkern isoliert werden, die für sie charakteristisch sind. Allerdings können die In-vitro-Kulturbedingungen das Verhalten der Zellen verändern, so dass unklar ist, ob sich die Zellen in vivo ähnlich verhalten werden. Es ist umstritten, ob es sich bei einigen vorgeschlagenen adulten Zellpopulationen wirklich um Stammzellen handelt. ⓘ
Embryonale
Embryonale Stammzellen (ESZ) sind die Zellen der inneren Zellmasse einer Blastozyste, die vor der Einnistung in die Gebärmutter gebildet wird. In der menschlichen Embryonalentwicklung wird das Blastozystenstadium 4-5 Tage nach der Befruchtung erreicht und besteht zu diesem Zeitpunkt aus 50-150 Zellen. WSZ sind pluripotent und bilden im Laufe der Entwicklung alle Ableger der drei Keimblätter: Ektoderm, Endoderm und Mesoderm. Mit anderen Worten, sie können sich zu jedem der mehr als 200 Zelltypen des erwachsenen Körpers entwickeln, wenn sie die für einen bestimmten Zelltyp erforderliche und ausreichende Stimulation erhalten. Sie tragen weder zu den extraembryonalen Membranen noch zur Plazenta bei. ⓘ
Während der Embryonalentwicklung teilen sich die Zellen der inneren Zellmasse ständig und spezialisieren sich weiter. So spezialisiert sich beispielsweise ein Teil des Ektoderms im dorsalen Teil des Embryos als "Neurektoderm", aus dem sich das spätere zentrale Nervensystem entwickelt. Später in der Entwicklung bildet das Neurektoderm durch Neurulation das Neuralrohr. Im Stadium des Neuralrohrs durchläuft der vordere Teil die Enzephalisation, um die Grundform des Gehirns zu erzeugen oder zu "mustern". In diesem Entwicklungsstadium wird der wichtigste Zelltyp des ZNS als neurale Stammzelle bezeichnet. ⓘ
Die neuralen Stammzellen erneuern sich selbst und gehen irgendwann in radiale gliale Vorläuferzellen (RGPs) über. Früh gebildete RGPs erneuern sich selbst durch symmetrische Teilung und bilden eine Reservoirgruppe von Vorläuferzellen. Diese Zellen gehen in einen neurogenen Zustand über und beginnen, sich asymmetrisch zu teilen, um eine große Vielfalt vieler verschiedener Neuronentypen zu erzeugen, die jeweils einzigartige Genexpression, morphologische und funktionelle Merkmale aufweisen. Der Prozess der Bildung von Neuronen aus radialen Gliazellen wird als Neurogenese bezeichnet. Die radiale Gliazelle hat eine charakteristische bipolare Morphologie mit stark verlängerten Fortsätzen, die sich über die gesamte Dicke der Neuralrohrwand erstrecken. Sie weist einige gliale Merkmale auf, insbesondere die Expression von glialem fibrillärem saurem Protein (GFAP). Die radiale Gliazelle ist die primäre neurale Stammzelle des sich entwickelnden ZNS der Wirbeltiere, und ihr Zellkörper befindet sich in der ventrikulären Zone, angrenzend an das sich entwickelnde Ventrikelsystem. Neurale Stammzellen sind auf die neuronalen Linien (Neuronen, Astrozyten und Oligodendrozyten) festgelegt, so dass ihre Potenz begrenzt ist. ⓘ
In der bisherigen Forschung wurden fast ausschließlich embryonale Stammzellen der Maus (mES) oder humane embryonale Stammzellen (hES) aus der frühen inneren Zellmasse verwendet. Beide haben die wesentlichen Stammzelleneigenschaften, benötigen jedoch sehr unterschiedliche Umgebungen, um einen undifferenzierten Zustand zu erhalten. ES-Zellen der Maus werden auf einer Gelatineschicht als extrazelluläre Matrix (zur Unterstützung) gezüchtet und benötigen Leukämie-Inhibitionsfaktor (LIF) im Serummedium. Ein Medikamentencocktail mit Hemmstoffen für GSK3B und den MAPK/ERK-Signalweg, genannt 2i, kann nachweislich die Pluripotenz in der Stammzellkultur erhalten. Menschliche WSZ werden auf einer Speiseschicht aus embryonalen Fibroblasten der Maus gezüchtet und benötigen die Anwesenheit des Wachstumsfaktors für Basisfibroblasten (bFGF oder FGF-2). Ohne optimale Kulturbedingungen oder genetische Manipulation differenzieren sich embryonale Stammzellen schnell. ⓘ
Eine menschliche embryonale Stammzelle wird auch durch die Expression verschiedener Transkriptionsfaktoren und Zelloberflächenproteine definiert. Die Transkriptionsfaktoren Oct-4, Nanog und Sox2 bilden das zentrale regulatorische Netzwerk, das die Unterdrückung von Genen, die zur Differenzierung führen, und die Erhaltung der Pluripotenz gewährleistet. Die am häufigsten zur Identifizierung von hES-Zellen verwendeten Zelloberflächenantigene sind die Glykolipide stadienspezifisches embryonales Antigen 3 und 4 sowie die Keratansulfat-Antigene Tra-1-60 und Tra-1-81. Die molekulare Definition einer Stammzelle umfasst viele weitere Proteine und ist weiterhin Gegenstand der Forschung. ⓘ
Durch die Verwendung menschlicher embryonaler Stammzellen zur Herstellung spezialisierter Zellen wie Nervenzellen oder Herzzellen im Labor können Wissenschaftler Zugang zu adulten menschlichen Zellen erhalten, ohne Gewebe von Patienten zu entnehmen. Sie können dann diese spezialisierten erwachsenen Zellen im Detail studieren, um Komplikationen von Krankheiten zu erkennen oder um die Reaktionen der Zellen auf vorgeschlagene neue Medikamente zu untersuchen. ⓘ
Aufgrund ihrer kombinierten Fähigkeiten der unbegrenzten Vermehrung und Pluripotenz stellen embryonale Stammzellen theoretisch eine potenzielle Quelle für die regenerative Medizin und den Ersatz von Gewebe nach Verletzungen oder Krankheiten dar, doch gibt es derzeit keine zugelassenen Behandlungen mit ES-Zellen. Der erste Versuch am Menschen wurde im Januar 2009 von der US Food and Drug Administration genehmigt. Die Studie am Menschen wurde jedoch erst am 13. Oktober 2010 in Atlanta zur Erforschung von Rückenmarksverletzungen eingeleitet. Am 14. November 2011 gab das Unternehmen, das die Studie durchführte (Geron Corporation), bekannt, dass es die weitere Entwicklung seiner Stammzellprogramme einstellen wird. Die Differenzierung von ES-Zellen in brauchbare Zellen bei gleichzeitiger Vermeidung von Transplantatabstoßungen sind nur einige der Hürden, vor denen die Forscher im Bereich der embryonalen Stammzellen noch stehen. Da embryonale Stammzellen pluripotent sind, benötigen sie spezifische Signale für eine korrekte Differenzierung - werden ES-Zellen direkt in einen anderen Körper injiziert, differenzieren sie sich in viele verschiedene Zelltypen und verursachen ein Teratom. Ethische Erwägungen hinsichtlich der Verwendung von ungeborenem menschlichem Gewebe sind ein weiterer Grund dafür, dass es keine zugelassenen Behandlungen mit embryonalen Stammzellen gibt. In vielen Ländern gibt es derzeit Moratorien oder Beschränkungen für die Forschung mit menschlichen ES-Zellen oder die Herstellung neuer menschlicher ES-Zelllinien. ⓘ
Kolonie humaner embryonaler Stammzellen auf embryonaler Fibroblasten-Fütterungsschicht der Maus ⓘ
Mesenchymale Stammzellen
Mesenchymale Stammzellen (MSC) sind als multipotent bekannt und kommen in erwachsenen Geweben vor, z. B. in Muskeln, Leber und Knochenmark. Mesenchymale Stammzellen fungieren in der Regel als strukturelle Stütze in verschiedenen Organen, wie oben erwähnt, und steuern die Bewegung von Substanzen. MSC können sich in zahlreiche Zellkategorien differenzieren, z. B. in Adipozyten, Osteozyten und Chondrozyten, die aus der Mesodermschicht stammen. Die Mesodermschicht sorgt für eine Vermehrung der Skelettelemente des Körpers, z. B. in Bezug auf den Knorpel oder Knochen. Der Begriff "meso" bedeutet Mitte, Infusion stammt aus dem Griechischen und bedeutet, dass mesenchymale Zellen in der Lage sind, sich in der frühen Embryonalentwicklung zwischen den ektodermalen und endodermalen Schichten zu bewegen und zu bewegen. Dieser Mechanismus hilft bei der Raumauffüllung und ist somit der Schlüssel für die Reparatur von Wunden in erwachsenen Organismen, die mit mesenchymalen Zellen in der Dermis (Haut), den Knochen oder den Muskeln zu tun haben. ⓘ
Es ist bekannt, dass mesenchymale Stammzellen für die regenerative Medizin von wesentlicher Bedeutung sind. Sie werden in klinischen Studien eingehend untersucht. Da sie leicht isoliert werden können und eine hohe Ausbeute und Plastizität aufweisen, sind sie in der Lage, Entzündungen zu lindern und das Zellwachstum, die Zelldifferenzierung und die Wiederherstellung von Gewebe nach Immunmodulation und Immunsuppression zu fördern. MSC stammen aus dem Knochenmark, was ein aggressives Verfahren erfordert, wenn es um die Isolierung der Quantität und Qualität der isolierten Zellen geht, und es variiert je nach Alter des Spenders. Vergleicht man die MSC-Raten in Knochenmarkaspiraten und Knochenmarkstroma, so weisen die Aspirate tendenziell niedrigere Raten von MSC auf als das Stroma. Es ist bekannt, dass MSZ heterogen sind und im Vergleich zu anderen Arten von Stammzellen, wie z. B. embryonalen Stammzellen, einen hohen Anteil an pluripotenten Markern aufweisen. Die Injektion von MSZ führt in erster Linie durch die Stimulierung der Angiogenese zur Wundheilung. ⓘ
Kontrolle des Zellzyklus
Embryonale Stammzellen (ESZ) haben die Fähigkeit, sich unbegrenzt zu teilen und dabei ihre Pluripotenz zu bewahren, was durch spezielle Mechanismen der Zellzykluskontrolle ermöglicht wird. Im Vergleich zu proliferierenden somatischen Zellen weisen WSZ einzigartige Merkmale des Zellzyklus auf, wie z. B. eine schnelle Zellteilung, die durch eine verkürzte G1-Phase, eine fehlende G0-Phase und Veränderungen der Zellzykluskontrollpunkte verursacht wird, wodurch sich die Zellen zu jedem Zeitpunkt überwiegend in der S-Phase befinden. Die schnelle Teilung von WSZ zeigt sich in ihrer kurzen Verdopplungszeit, die zwischen 8 und 10 Stunden liegt, während somatische Zellen eine Verdopplungszeit von etwa 20 Stunden oder länger haben. Bei der Differenzierung der Zellen ändern sich diese Eigenschaften: Die G1- und G2-Phasen verlängern sich, was zu längeren Zellteilungszyklen führt. Dies deutet darauf hin, dass eine bestimmte Struktur des Zellzyklus zur Entstehung der Pluripotenz beitragen kann. ⓘ
Insbesondere weil die G1-Phase die Phase ist, in der die Zellen eine erhöhte Empfindlichkeit für die Differenzierung aufweisen, ist die verkürzte G1-Phase eines der Hauptmerkmale von WSZ und spielt eine wichtige Rolle bei der Aufrechterhaltung des undifferenzierten Phänotyps. Obwohl der genaue molekulare Mechanismus nur teilweise verstanden ist, haben mehrere Studien Aufschluss darüber gegeben, wie ESCs die G1-Phase - und möglicherweise auch andere Phasen - so schnell durchlaufen. ⓘ
Der Zellzyklus wird durch ein komplexes Netzwerk von Cyclinen, Cyclin-abhängigen Kinasen (Cdk), Cyclin-abhängigen Kinase-Inhibitoren (Cdkn), Taschenproteinen der Retinoblastom-Familie (Rb) und anderen akzessorischen Faktoren gesteuert. Grundlegende Erkenntnisse über die besondere Regulierung des ESC-Zellzyklus wurden durch Studien an Maus-ESCs (mESCs) gewonnen. mESCs wiesen einen Zellzyklus mit stark verkürzter G1-Phase auf, der es den Zellen ermöglichte, schnell zwischen M- und S-Phase zu wechseln. In einem somatischen Zellzyklus wird eine oszillierende Aktivität von Cyclin-Cdk-Komplexen beobachtet, die wichtige Regulatoren des Zellzyklus kontrolliert, um unidirektionale Übergänge zwischen den Phasen zu bewirken: Cyclin D und Cdk4/6 sind in der G1-Phase aktiv, während Cyclin E und Cdk2 in der späten G1- und S-Phase aktiv sind; und Cyclin A und Cdk2 sind in der S-Phase und G2 aktiv, während Cyclin B und Cdk1 in der G2- und M-Phase aktiv sind. In mESCs ist diese typischerweise geordnete und oszillierende Aktivität der Cyclin-Cdk-Komplexe jedoch nicht vorhanden. Vielmehr ist der Cyclin E/Cdk2-Komplex während des gesamten Zyklus konstitutiv aktiv und hält das Retinoblastom-Protein (pRb) hyperphosphoryliert und damit inaktiv. Dies ermöglicht einen direkten Übergang von der M-Phase in die späte G1-Phase, was zum Fehlen von Zyklinen vom D-Typ und damit zu einer verkürzten G1-Phase führt. Die Cdk2-Aktivität ist sowohl für die Regulierung des Zellzyklus als auch für die Entscheidung über den Zellstatus in mESCs von entscheidender Bedeutung; eine Herunterregulierung der Cdk2-Aktivität verlängert die G1-Phase, führt zu einem somatischen, zellähnlichen Zellzyklus und induziert die Expression von Differenzierungsmarkern. ⓘ
Bei menschlichen WSZ (hESZ) ist die Dauer der G1-Phase drastisch verkürzt. Dies wird auf hohe mRNA-Konzentrationen der G1-verwandten Cyclin-D2- und Cdk4-Gene und niedrige Konzentrationen von Zellzyklus-regulierenden Proteinen zurückgeführt, die die Zellzyklusprogression in G1 hemmen, wie p21CipP1, p27Kip1 und p57Kip2. Darüber hinaus werden Regulatoren der Cdk4- und Cdk6-Aktivität, wie z. B. Mitglieder der Ink-Familie von Inhibitoren (p15, p16, p18 und p19), in geringen Mengen oder gar nicht exprimiert. Ähnlich wie bei mESC weisen hESC eine hohe Cdk-Aktivität auf, wobei Cdk2 die höchste Kinaseaktivität aufweist. Ähnlich wie bei mESC zeigen hESCs die Bedeutung von Cdk2 bei der Regulierung der G1-Phase, indem sie zeigen, dass der Übergang von G1 nach S verzögert wird, wenn die Cdk2-Aktivität gehemmt wird, und dass G1 verhaftet wird, wenn Cdk2 ausgeschaltet wird. Im Gegensatz zu mESCs haben hESCs jedoch eine funktionelle G1-Phase. hESCs zeigen, dass die Aktivitäten der Komplexe Cyclin E/Cdk2 und Cyclin A/Cdk2 zyklusabhängig sind und der Rb-Kontrollpunkt in G1 funktioniert. ⓘ
ESCs zeichnen sich auch durch eine Nichtfunktionalität des G1-Kontrollpunkts aus, obwohl dieser für die Aufrechterhaltung der Genomstabilität entscheidend ist. Als Reaktion auf DNA-Schäden halten ESCs nicht in G1 an, um DNA-Schäden zu reparieren, sondern sind stattdessen von S- und G2/M-Checkpoints abhängig oder unterliegen der Apoptose. Das Fehlen des G1-Kontrollpunkts in WSZ ermöglicht die Beseitigung von Zellen mit geschädigter DNA, wodurch mögliche Mutationen aufgrund einer ungenauen DNA-Reparatur vermieden werden. In Übereinstimmung mit dieser Idee reagieren WSZ überempfindlich auf DNA-Schäden, um die an die nächste Generation weitergegebenen Mutationen zu minimieren. ⓘ
Fötus
Die primitiven Stammzellen, die sich in den Organen von Föten befinden, werden als fetale Stammzellen bezeichnet. ⓘ
Es gibt zwei Arten von fetalen Stammzellen:
- Echte fetale Stammzellen stammen aus dem Gewebe des Fötus selbst und werden im Allgemeinen nach einer Abtreibung gewonnen. Diese Stammzellen sind nicht unsterblich, haben aber eine hohe Teilungsrate und sind multipotent.
- Extraembryonale fetale Stammzellen stammen aus extraembryonalen Membranen und werden im Allgemeinen nicht von adulten Stammzellen unterschieden. Diese Stammzellen werden nach der Geburt erworben, sie sind nicht unsterblich, haben aber eine hohe Zellteilungsrate und sind pluripotent. ⓘ
Adulte

Adulte Stammzellen, auch somatische (von griechisch σωματικóς, "des Körpers") Stammzellen genannt, sind Stammzellen, die das Gewebe, in dem sie sich befinden, erhalten und reparieren. Sie können sowohl bei Kindern als auch bei Erwachsenen gefunden werden. ⓘ
Es gibt drei bekannte zugängliche Quellen für autologe adulte Stammzellen beim Menschen:
- Knochenmark, das in der Regel durch eine chirurgische Entnahme aus den Beckenknochen gewonnen werden muss.
- Fettgewebe (Fettzellen), das durch Fettabsaugung gewonnen werden muss.
- Blut, das durch Apherese entnommen werden muss, wobei dem Spender Blut abgenommen wird (ähnlich wie bei einer Blutspende) und dieses durch eine Maschine geleitet wird, die die Stammzellen extrahiert und andere Teile des Blutes an den Spender zurückgibt.
Stammzellen können auch direkt nach der Geburt aus Nabelschnurblut entnommen werden. Von allen Stammzellentypen ist die autologe Entnahme mit dem geringsten Risiko verbunden. Per Definition werden autologe Zellen aus dem eigenen Körper gewonnen, so wie man auch sein eigenes Blut für elektive chirurgische Eingriffe aufbewahren kann. ⓘ
Pluripotente adulte Stammzellen sind selten und im Allgemeinen in geringer Zahl vorhanden, aber sie können im Nabelschnurblut und anderen Geweben gefunden werden. Das Knochenmark ist eine reichhaltige Quelle für adulte Stammzellen, die bei der Behandlung verschiedener Krankheiten wie Leberzirrhose, chronischer Ischämie der Gliedmaßen und Herzinsuffizienz im Endstadium eingesetzt werden. Die Menge der Knochenmarkstammzellen nimmt mit dem Alter ab und ist bei Männern während der Fortpflanzungsjahre größer als bei Frauen. Ein Großteil der bisherigen Forschung an adulten Stammzellen zielt darauf ab, deren Potenz und Selbsterneuerungsfähigkeit zu charakterisieren. Mit zunehmendem Alter akkumulieren DNA-Schäden sowohl in den Stammzellen als auch in den Zellen, die die Stammzellenumgebung bilden. Diese Anhäufung wird zumindest teilweise für die zunehmende Dysfunktion der Stammzellen im Alter verantwortlich gemacht (siehe DNA-Schadenstheorie des Alterns). ⓘ
Die meisten adulten Stammzellen sind liniengebunden (multipotent) und werden im Allgemeinen nach ihrem Gewebeursprung bezeichnet (mesenchymale Stammzellen, aus Fettgewebe stammende Stammzellen, endotheliale Stammzellen, Zahnmarkstammzellen usw.). Muse-Zellen (multi-lineage differentiating stress enduring cells) sind ein erst kürzlich entdeckter pluripotenter Stammzellentyp, der in verschiedenen adulten Geweben, einschließlich Fettgewebe, Hautfibroblasten und Knochenmark, vorkommt. Obwohl sie selten sind, lassen sich Muse-Zellen durch ihre Expression von SSEA-3, einem Marker für undifferenzierte Stammzellen, und allgemeinen mesenchymalen Stammzellmarkern wie CD105 identifizieren. In der Einzelzellsuspensionskultur bilden die Zellen Cluster, die sowohl in ihrer Morphologie als auch in ihrer Genexpression, einschließlich der kanonischen Pluripotenzmarker Oct4, Sox2 und Nanog, den Embryoidkörpern ähneln. ⓘ
Adulte Stammzellen werden seit vielen Jahren erfolgreich zur Behandlung von Leukämie und verwandten Knochen-/Blutkrebsarten durch Knochenmarktransplantation eingesetzt. Adulte Stammzellen werden auch in der Veterinärmedizin zur Behandlung von Sehnen- und Bänderverletzungen bei Pferden eingesetzt. ⓘ
Die Verwendung adulter Stammzellen in der Forschung und Therapie ist nicht so umstritten wie die Verwendung embryonaler Stammzellen, da die Herstellung adulter Stammzellen nicht die Zerstörung eines Embryos erfordert. Außerdem besteht in Fällen, in denen adulte Stammzellen vom vorgesehenen Empfänger gewonnen werden (Autotransplantation), praktisch kein Abstoßungsrisiko. Infolgedessen wird die Forschung mit adulten Stammzellen von der US-Regierung verstärkt gefördert. ⓘ
Angesichts des steigenden Bedarfs an menschlichen adulten Stammzellen sowohl für die Forschung als auch für klinische Zwecke (in der Regel werden pro Behandlung 1-5 Millionen Zellen pro kg Körpergewicht benötigt) ist es von größter Bedeutung, die Lücke zwischen der Notwendigkeit, die Zellen in vitro zu vermehren, und der Fähigkeit, die der replikativen Seneszenz zugrunde liegenden Faktoren zu nutzen, zu schließen. Es ist bekannt, dass adulte Stammzellen in vitro nur eine begrenzte Lebensdauer haben und bei Beginn der in vitro-Kultur fast unbemerkt in die replikative Seneszenz übergehen. ⓘ
Die Gruppe der postembryonalen Stammzellen umfasst all jene Stammzellen, die nach Abschluss der Embryonalentwicklung im Organismus von Säugetieren vorkommen. Nach ihrem ontogenetischen Alter werden sie weiterhin in fötale, neonatale und adulte Stammzellen unterteilt. ⓘ
Das Differenzierungspotential von postembryonalen Stammzellen ist nach gegenwärtiger Erkenntnis auf die Ausreifung genetisch determinierter Gewebe – etwa der Haut, der Leber oder des hämatopoetischen Systems – beschränkt. Sie werden daher im Gegensatz zu den ES-Zellen nicht mehr als pluripotent, sondern nur noch als multipotent bezeichnet. ⓘ
Amniotische
Diese multipotenten Stammzellen, die auch als perinatale Stammzellen bezeichnet werden, finden sich im Fruchtwasser und im Nabelschnurblut. Diese Stammzellen sind sehr aktiv, expandieren ohne Fütterung in großem Umfang und sind nicht tumorigen. Amniotische Stammzellen sind multipotent und können sich in Zellen der adipogenen, osteogenen, myogenen, endothelialen, hepatischen und auch neuronalen Linie differenzieren. Amniotische Stammzellen sind ein Thema aktiver Forschung. ⓘ
Die Verwendung von Stammzellen aus Fruchtwasser überwindet die ethischen Einwände gegen die Verwendung menschlicher Embryonen als Zellquelle. Die römisch-katholische Lehre verbietet die Verwendung embryonaler Stammzellen zu Versuchszwecken; dementsprechend bezeichnete die vatikanische Zeitung "Osservatore Romano" Amnionstammzellen als "die Zukunft der Medizin". ⓘ
Es ist möglich, Amnionstammzellen für Spender oder zur autologen Verwendung zu sammeln: Die erste US-amerikanische Amnionstammzellenbank wurde 2009 in Medford, MA, von der Biocell Center Corporation eröffnet und arbeitet mit verschiedenen Krankenhäusern und Universitäten in der ganzen Welt zusammen. ⓘ
Induzierte pluripotente Zellen
Adulte Stammzellen haben eine begrenzte Potenz; im Gegensatz zu embryonalen Stammzellen (ESC) sind sie nicht in der Lage, sich in Zellen aus allen drei Keimschichten zu differenzieren. Daher gelten sie als multipotent. ⓘ
Die Reprogrammierung ermöglicht es jedoch, aus adulten Zellen pluripotente Zellen, induzierte pluripotente Stammzellen (iPSCs), zu erzeugen. Dabei handelt es sich nicht um adulte Stammzellen, sondern um somatische Zellen (z. B. Epithelzellen), die umprogrammiert wurden, um Zellen mit pluripotenten Fähigkeiten hervorzubringen. Durch genetische Umprogrammierung mit Protein-Transkriptionsfaktoren wurden pluripotente Stammzellen mit ESC-ähnlichen Fähigkeiten gewonnen. Der erste Nachweis von induzierten pluripotenten Stammzellen wurde von Shinya Yamanaka und seinen Kollegen an der Universität Kyoto erbracht. Sie verwendeten die Transkriptionsfaktoren Oct3/4, Sox2, c-Myc und Klf4, um Mäusefibroblastenzellen in pluripotente Zellen umzuprogrammieren. In späteren Arbeiten wurden diese Faktoren verwendet, um Pluripotenz in menschlichen Fibroblastenzellen zu induzieren. Junying Yu, James Thomson und ihre Kollegen von der University of Wisconsin-Madison verwendeten eine andere Gruppe von Faktoren, Oct4, Sox2, Nanog und Lin28, und führten ihre Experimente mit Zellen aus menschlicher Vorhaut durch. Dennoch konnten sie Yamanakas Erkenntnis, dass die Induktion von Pluripotenz in menschlichen Zellen möglich ist, wiederholen. ⓘ
Induzierte pluripotente Stammzellen unterscheiden sich von embryonalen Stammzellen. Sie haben zwar viele ähnliche Eigenschaften wie Pluripotenz und Differenzierungspotenzial, die Expression von Pluripotenzgenen, epigenetische Muster, die Bildung von embryoiden Körpern und Teratomen sowie die Bildung lebensfähiger Chimären, aber innerhalb dieser Eigenschaften gibt es viele Unterschiede. Das Chromatin von iPSCs scheint stärker "geschlossen" oder methyliert zu sein als das von ESCs. Ähnlich verhält es sich mit dem Muster der Genexpression zwischen ESCs und iPSCs oder sogar iPSCs unterschiedlicher Abstammung. Es stellt sich also die Frage nach der "Vollständigkeit" der Reprogrammierung und dem somatischen Gedächtnis induzierter pluripotenter Stammzellen. Dennoch scheint es möglich zu sein, somatische Zellen in pluripotente Zellen zu verwandeln. ⓘ
Aufgrund des Erfolgs dieser Experimente hat Ian Wilmut, der an der Erschaffung des ersten geklonten Tieres Dolly the Sheep beteiligt war, angekündigt, dass er den Kerntransfer somatischer Zellen als Forschungsmethode aufgeben wird. ⓘ
IPSCs haben der Medizin durch die Entdeckung zahlreicher Möglichkeiten zur Heilung von Krankheiten erheblich geholfen. Seitdem menschliche IPSCc den Vorteil haben, dass sie in vitro Modelle zur Untersuchung von Toxinen und Pathogenese herstellen können. ⓘ
Darüber hinaus bieten induzierte pluripotente Stammzellen mehrere therapeutische Vorteile. Wie WSZ sind sie pluripotent. Sie haben daher ein großes Differenzierungspotenzial; theoretisch könnten sie jede Zelle im menschlichen Körper hervorbringen (wenn die Reprogrammierung zur Pluripotenz "vollständig" wäre). Darüber hinaus könnten sie es Ärzten im Gegensatz zu WSZ ermöglichen, für jeden einzelnen Patienten eine eigene pluripotente Stammzelllinie zu schaffen. Gefrorene Blutproben können als wertvolle Quelle für induzierte pluripotente Stammzellen genutzt werden. Patientenspezifische Stammzellen ermöglichen es, vor einer medikamentösen Behandlung auf Nebenwirkungen zu prüfen und das Risiko einer Transplantatabstoßung zu verringern. Trotz ihres derzeit begrenzten therapeutischen Einsatzes bergen iPSCs ein großes Potenzial für den künftigen Einsatz in der medizinischen Behandlung und Forschung. ⓘ
Zur erstmaligen Reprogrammierung wurden die Gene Oct-4, Sox-2, c-Myc und Klf-4 mit Retroviren in die Zellen geschleust (Transduktion). Im Tierversuch entwickelte ein Fünftel der verwendeten Mäuse Tumoren, vermutlich, weil zwei der verwendeten Gene krebsfördernd sein können (sog. Protoonkogene). Um bei medizinischer Anwendung ein Risiko durch eingebrachte krebsfördernde Gene auszuschließen, werden alternative Methoden zur Reprogrammierung gesucht. Geforscht wird u. a. an kleinen Molekülen (z. B. Peptiden), die die natürlich im Erbgut der Zelle vorkommenden Stammzellgene aktivieren. Um eine Tumorbildung zu vermeiden, versuchen Forscher außerdem die Methode der Geneinschleusung mit Retroviren und die Nutzung der Protoonkogene c-Myc und Klf-4 zu vermeiden, indem die Einschleusung mit nicht-integrierenden Adenoviren und alternativen Genen (Nanog, lin-28) durchgeführt wird. ⓘ
Im Gegensatz zu Retroviren wird die gewünschte Gensequenz durch Adenoviren nicht in das Genom der Wirtszelle integriert, womit die Integrität des Wirtsgenoms erhalten bleibt. ⓘ
Darüber hinaus ist es gelungen, iPS-Zellen durch Transfektion nur eines Pluripotenzgens aus Zellen zu erzeugen, die die übrigen drei Gene natürlich exprimieren. ⓘ
Im Dezember 2007 berichteten Forscher um Jacob Hanna vom Whitehead Institute for Biomedical Research im US-amerikanischen Cambridge, dass es gelungen sei, mit iPS-Zellen Mäuse zu heilen, die an Sichelzellenanämie gelitten hatten. In den aus dem Schwanz mittels Reprogrammierung gewonnenen iPS-Zellen ersetzten die Forscher das veränderte Gen, welches die Sichelzellenanämie auslöst durch die gesunde Erbanlage mittels homologer Rekombination. Aus den so behandelten Stammzellen wurden blutbildende Vorläuferzellen gezüchtet, die sich zu verschiedenen Blutzellen und Zellen des Immunsystems weiterentwickeln können. Die Vorläuferzellen wurden in die erkrankten Mäuse transplantiert, wo sie offenbar zu gesunden Blutzellen heranwuchsen. Wie das Team berichtet, verschwanden die Symptome der Versuchstiere durch die Behandlung nahezu vollständig. Diese und verwandte Veröffentlichungen sind allerdings mit gewissem Vorbehalt zu betrachten. Es sind mehrere unklare Angaben zu Proteinen, zur zellulären Biochemie und zu Zellprozessen zu finden, wie z. B. zum Homöoboxprotein NANOG oder zu c-Myc bezüglich Krebsentstehung. ⓘ
In Deutschland forschen u. a. Hans Schöler, Direktor am Max-Planck-Institut für molekulare Biomedizin in Münster und Oliver Brüstle, Direktor des Instituts für Rekonstruktive Neurobiologie der Universität Bonn über iPS-Zellen. Die beiden Wissenschaftler leiten gemeinsam das Netzwerk Stammzellforschung NRW. Ihre Erwartungen richten sich aus der Stammzellforschung heraus auf die Entwicklung von Medikamenten, die sie mittelfristig als besonders vielversprechend ansehen. ⓘ
Kontrolle des Zellzyklus
Die Schlüsselfaktoren, die den Zellzyklus steuern, regulieren auch die Pluripotenz. So kann durch die Manipulation relevanter Gene die Pluripotenz erhalten und somatische Zellen in einen induzierten pluripotenten Zustand umprogrammiert werden. Die Reprogrammierung somatischer Zellen ist jedoch oft wenig effizient und gilt als stochastisch. ⓘ
Mit der Idee, dass ein schnellerer Zellzyklus eine Schlüsselkomponente der Pluripotenz ist, kann die Effizienz der Reprogrammierung verbessert werden. Zu den Methoden zur Verbesserung der Pluripotenz durch Manipulation von Zellzyklusregulatoren gehören: Überexpression von Cyclin D/Cdk4, Phosphorylierung von Sox2 an S39 und S253, Überexpression von Cyclin A und Cyclin E, Knockdown von Rb und Knockdown von Mitgliedern der Cip/Kip-Familie oder der Ink-Familie. Außerdem korreliert die Effizienz der Reprogrammierung mit der Anzahl der Zellteilungen während der stochastischen Phase, was durch die zunehmende Ineffizienz der Reprogrammierung älterer oder langsam tauchender Zellen nahegelegt wird. ⓘ
Abstammung
Die Abstammung ist ein wichtiges Verfahren zur Analyse von sich entwickelnden Embryonen. Die Zellabfolge zeigt die Beziehung zwischen den Zellen bei jeder Teilung. Dies hilft bei der Analyse von Stammzelllinien, die dabei helfen, die Effektivität der Stammzellen, ihre Lebensspanne und andere Faktoren zu erkennen. Mit der Technik der Zellabfolge können mutierte Gene in Stammzellklonen analysiert werden, die bei der Erkennung genetischer Pfade helfen können. Diese Bahnen können die Leistung der Stammzellen regulieren. ⓘ
Um die Selbsterneuerung zu gewährleisten, durchlaufen Stammzellen zwei Arten der Zellteilung (siehe Diagramm Stammzellteilung und -differenzierung). Bei der symmetrischen Teilung entstehen zwei identische Tochterzellen, die beide mit Stammzelleigenschaften ausgestattet sind. Bei der asymmetrischen Teilung hingegen entstehen nur eine Stammzelle und eine Vorläuferzelle mit begrenztem Selbsterneuerungspotenzial. Vorläuferzellen können mehrere Zellteilungsrunden durchlaufen, bevor sie sich schließlich in eine reife Zelle differenzieren. Es ist möglich, dass der molekulare Unterschied zwischen symmetrischen und asymmetrischen Teilungen in der unterschiedlichen Segregation von Zellmembranproteinen (wie Rezeptoren) zwischen den Tochterzellen liegt. ⓘ
Eine alternative Theorie besagt, dass Stammzellen aufgrund von Umweltfaktoren in ihrer speziellen Nische undifferenziert bleiben. Stammzellen differenzieren sich, wenn sie diese Nische verlassen oder diese Signale nicht mehr empfangen. In Studien am Keimblatt von Drosophila wurden die Signale Decapentaplegie und Adherens Junctions identifiziert, die die Differenzierung von Stammzellen am Keimblatt verhindern. ⓘ
Therapien
Unter Stammzelltherapie versteht man die Verwendung von Stammzellen zur Behandlung oder Vorbeugung einer Krankheit oder eines Zustands. Die Knochenmarktransplantation ist eine Form der Stammzelltherapie, die seit vielen Jahren eingesetzt wird, da sie sich in klinischen Studien als wirksam erwiesen hat. ⓘ
Die Implantation von Stammzellen kann dazu beitragen, die linke Herzkammer zu stärken und bei Patienten, die in der Vergangenheit einen Herzinfarkt erlitten haben, das Herzgewebe zu erhalten. ⓘ
Vorteile
Stammzellbehandlungen können die Symptome der zu behandelnden Krankheit oder des Zustands lindern. Die Linderung der Symptome kann es den Patienten ermöglichen, die Medikamenteneinnahme für die Krankheit oder das Leiden zu reduzieren. Die Stammzellenbehandlung kann der Gesellschaft auch Wissen vermitteln, um das Verständnis für Stammzellen und künftige Behandlungen zu fördern. Das Credo der Ärzte ist es, keinen Schaden anzurichten, und Stammzellen machen dies einfacher als je zuvor. Chirurgische Verfahren sind ihrem Wesen nach schädlich. Gewebe muss abgetrennt werden, um ein erfolgreiches Ergebnis zu erzielen. Mit Stammzellen kann man die Gefahren von chirurgischen Eingriffen vermeiden. Außerdem besteht die Möglichkeit einer Erkrankung, und wenn der Eingriff fehlschlägt, kann eine weitere Operation erforderlich werden. Auch die mit einer Anästhesie verbundenen Risiken können mit Stammzellen ausgeschlossen werden. Darüber hinaus wurden die Stammzellen aus dem Körper des Patienten entnommen und dort eingesetzt, wo sie gebraucht werden. Da sie aus dem eigenen Körper des Patienten stammen, wird dies als autologe Behandlung bezeichnet. Autologe Behandlungen gelten als die sichersten, da die Wahrscheinlichkeit einer Abstoßung der Spendersubstanz gleich null ist. ⓘ
Nachteile
Stammzellbehandlungen können eine Immunsuppression erfordern, weil vor der Transplantation eine Bestrahlung erforderlich ist, um die früheren Zellen des Patienten zu entfernen, oder weil sich das Immunsystem des Patienten gegen die Stammzellen richten könnte. Ein Ansatz zur Vermeidung der zweiten Möglichkeit ist die Verwendung von Stammzellen desselben Patienten, der behandelt wird. ⓘ
Die Pluripotenz bestimmter Stammzellen könnte es auch schwierig machen, einen bestimmten Zelltyp zu erhalten. Es ist auch schwierig, genau den benötigten Zelltyp zu erhalten, da sich nicht alle Zellen einer Population gleichmäßig differenzieren. Undifferenzierte Zellen können andere als die gewünschten Gewebetypen bilden. ⓘ
Einige Stammzellen bilden nach der Transplantation Tumore; Pluripotenz wird mit der Tumorbildung in Verbindung gebracht, insbesondere bei embryonalen Stammzellen, fetalen Stammzellen und induzierten pluripotenten Stammzellen. Fötale Stammzellen bilden trotz ihrer Pluripotenz Tumore. ⓘ
Die Verwendung und Erforschung embryonaler Stammzellen ist auch ethisch bedenklich. Die Entnahme von Zellen aus der Blastozyste führt zum Tod der Blastozyste. Die Frage ist, ob die Blastozyste als menschliches Leben betrachtet werden sollte oder nicht. Die Debatte zu diesem Thema ist hauptsächlich eine philosophische, keine wissenschaftliche. ⓘ
Stammzellentourismus
Unter Stammzellentourismus versteht man die Branche, in der Patienten (und manchmal auch ihre Familien) in ein anderes Land reisen, um dort nicht zugelassene, aber im Internet als erwiesenermaßen heilend angepriesene Stammzellenverfahren zu erhalten. ⓘ
In den Vereinigten Staaten hat es in den letzten Jahren eine explosionsartige Zunahme von "Stammzellenkliniken" gegeben. Stammzellenbehandlungen sind für die Kliniken äußerst profitabel. Die Werbung klingt überzeugend, aber die Wirksamkeit und Sicherheit der Verfahren ist nicht bewiesen. Bei den Patienten kommt es manchmal zu Komplikationen wie Wirbelsäulentumoren und Tod. Auch die hohen Kosten können zum finanziellen Ruin führen. Den Forschern zufolge ist es notwendig, die Öffentlichkeit, die Patienten und die Ärzte über dieses Thema aufzuklären. ⓘ
Nach Angaben der Internationalen Gesellschaft für Stammzellenforschung, der größten akademischen Organisation, die sich für die Stammzellenforschung einsetzt, befinden sich Stammzelltherapien noch in der Entwicklung und können noch nicht als bewiesen gelten. Die Ärzte sollten die Patienten darüber informieren, dass in klinischen Studien weiterhin untersucht wird, ob diese Therapien sicher und wirksam sind, dass aber unethische Kliniken sie als bewiesen darstellen. ⓘ
Forschung
Einige der grundlegenden Patente für humane embryonale Stammzellen sind im Besitz der Wisconsin Alumni Research Foundation (WARF) - es sind die Patente 5.843.780, 6.200.806 und 7.029.913, die von James A. Thomson erfunden wurden. Die WARF setzt diese Patente nicht gegen akademische Wissenschaftler durch, wohl aber gegen Unternehmen. ⓘ
Im Jahr 2006 beantragte die Public Patent Foundation im Namen ihres Kunden, der gemeinnützigen Patentwächtergruppe Consumer Watchdog (ehemals Foundation for Taxpayer and Consumer Rights), beim US-Patent- und Markenamt (USPTO) eine erneute Prüfung der drei Patente. Im Rahmen des Überprüfungsverfahrens, das mehrere Diskussionsrunden zwischen dem USPTO und den Parteien umfasst, stimmte das USPTO zunächst mit Consumer Watchdog überein und wies alle Ansprüche in allen drei Patenten zurück. Daraufhin änderte WARF die Ansprüche aller drei Patente, um sie enger zu fassen, und 2008 befand das USPTO die geänderten Ansprüche in allen drei Patenten für patentierbar. Gegen die Entscheidung zu einem der Patente (7.029.913) konnte Berufung eingelegt werden, gegen die Entscheidungen zu den beiden anderen nicht. Consumer Watchdog legte gegen die Erteilung des Patents 7.029.913 Berufung beim Board of Patent Appeals and Interferences (BPAI) des USPTO ein, das der Berufung stattgab. 2010 entschied das BPAI, dass die geänderten Ansprüche des Patents 7.029.913 nicht patentierbar seien. WARF war jedoch in der Lage, den Fall erneut zu verfolgen und änderte die Ansprüche des Patents '913 erneut, um sie enger zu fassen, und im Januar 2013 wurden die geänderten Ansprüche zugelassen. ⓘ
Im Juli 2013 kündigte Consumer Watchdog an, dass sie gegen die Entscheidung, die Ansprüche des Patents '913 zuzulassen, Berufung beim US-Berufungsgericht für den Federal Circuit (CAFC) einlegen würde, dem Bundesberufungsgericht, das für Patentfälle zuständig ist. Bei einer Anhörung im Dezember 2013 warf das CAFC die Frage auf, ob Consumer Watchdog rechtlich befugt ist, Berufung einzulegen; der Fall konnte nicht weiterverfolgt werden, bis diese Frage geklärt war. ⓘ
Nachforschungen

Zu den Krankheiten und Zuständen, bei denen die Behandlung mit Stammzellen untersucht wird, gehören:
- Diabetes
- Androgene Alopezie und Haarausfall
- Rheumatoide Arthritis
- Parkinsonsche Krankheit
- Alzheimer-Krankheit
- Osteoarthritis
- Schlaganfall und Schädel-Hirn-Trauma-Behandlung
- Lernbehinderung aufgrund einer angeborenen Störung
- Behebung von Rückenmarksverletzungen
- Herzinfarkt
- Anti-Krebs-Behandlungen
- Rückgängigmachung von Kahlheit
- Ersetzen fehlender Zähne
- Gehör reparieren
- Wiederherstellung der Sehkraft und Reparatur von Hornhautschäden
- Amyotrophe Lateralsklerose
- Morbus Crohn
- Wundheilung
- Männliche Unfruchtbarkeit aufgrund fehlender spermatogonaler Stammzellen. In neueren Studien haben Wissenschaftler einen Weg gefunden, dieses Problem zu lösen, indem sie eine Zelle umprogrammieren und sie in eine Samenzelle verwandeln. Andere Studien haben die Wiederherstellung der Spermatogenese durch das Einbringen menschlicher iPSC-Zellen in die Hoden von Mäusen nachgewiesen. Dies könnte das Ende der Azoospermie bedeuten.
- Weibliche Unfruchtbarkeit: Eizellen aus embryonalen Stammzellen. Wissenschaftler haben die ovariellen Stammzellen gefunden, eine seltene Art von Zellen (0,014 %), die im Eierstock vorkommen. Sie könnten nicht nur zur Behandlung von Unfruchtbarkeit, sondern auch von vorzeitiger Eierstockinsuffizienz eingesetzt werden. ⓘ
Die Forschung arbeitet an der Erschließung verschiedener Quellen für Stammzellen und an der Anwendung von Stammzellenbehandlungen bei neurodegenerativen Krankheiten und Zuständen, Diabetes, Herzkrankheiten und anderen Erkrankungen. Außerdem wird an der Erzeugung von Organoiden mit Hilfe von Stammzellen geforscht, die ein besseres Verständnis der menschlichen Entwicklung, der Organogenese und der Modellierung menschlicher Krankheiten ermöglichen würden. ⓘ
In den letzten Jahren, als Wissenschaftler in der Lage waren, embryonale Stammzellen zu isolieren und zu kultivieren, und als Wissenschaftler zunehmend in der Lage waren, Stammzellen mit Hilfe des somatischen Zellkerntransfers und Techniken zur Erzeugung induzierter pluripotenter Stammzellen zu erzeugen, kam es zu Kontroversen, sowohl im Zusammenhang mit der Abtreibungspolitik als auch mit dem Klonen von Menschen. ⓘ
Hepatotoxizität und arzneimittelinduzierte Leberschäden sind für eine beträchtliche Anzahl von Misserfolgen bei der Entwicklung neuer Arzneimittel und für die Rücknahme vom Markt verantwortlich, was den Bedarf an Screening-Assays, wie z. B. aus Stammzellen abgeleiteten hepatozytenähnlichen Zellen, verdeutlicht, die in der Lage sind, Toxizität in einem frühen Stadium des Arzneimittelentwicklungsprozesses zu erkennen. ⓘ
Bemerkenswerte Studien
Im August 2021 veröffentlichten Forscher des Princess Margaret Cancer Centre des University Health Network ihre Entdeckung eines Ruhemechanismus in wichtigen Stammzellen, der zur Entwicklung künftiger Krebsbehandlungen beitragen könnte. ⓘ
Embryonale Stammzellen
Klonen
Neben der Gewinnung von ES-Zellen aus IVF-Blastozysten ist auch eine Gewinnung von ES-Zellen durch Klonen von Embryonen möglich. Grundlage für diese Möglichkeit war das erste erfolgreiche Klonen eines Säugetiers im Jahr 1996, des Schafs „Dolly“. Unter Nutzung dieser Technik kann durch Übertragung des Zellkerns aus einer Körperzelle in eine unbefruchtete, von der inneren Zellmasse befreite Eizelle ein früher Embryo entstehen, aus dem ES-Zellen angelegt werden können. Die Methode hätte bei der Anwendung auf den Menschen den Vorteil, dass mit dem Spender genetisch (und damit immunologisch) identische ES-Zellen zur Verfügung stünden. ⓘ
Die Forschung an embryonalen Stammzellen gelang auch durch gefälschte Ergebnisse in den Fokus der Öffentlichkeit: Im Jahr 2004 publizierte das Forschungsteam um den südkoreanischen Tiermediziner Hwang Woo-suk, es sei erstmals gelungen, einen menschlichen Embryo zu klonen und auf diese Weise Stammzelllinien zu gewinnen (Therapeutisches Klonen). 2005 folgte eine Publikation, ebenfalls in der angesehenen Fachzeitschrift Science, der zufolge die weltweit ersten maßgeschneiderten embryonalen Stammzellen für schwerstkranke Patienten etabliert worden seien. Beide Publikationen stellten sich als weitgehend gefälscht heraus. ⓘ
Einen möglichen Durchbruch im Therapeutischen Klonen von Primaten stellen die erstmals im Juni 2007 vorgestellten Ergebnisse eines US-amerikanischen Forscherteams um Shoukhrat Mitalipov dar. Dem Team gelang es, Rhesusaffen zu klonen und aus den erhaltenen Embryonen zwei Linien embryonaler Stammzellen zu gewinnen. Angewandt wurde dabei das gleiche Verfahren wie bei dem Schaf „Dolly“. Diese Ergebnisse wurden am 14. November 2007 von unabhängiger Seite bestätigt. ⓘ
Ethische Kontroverse
Die Art der Gewinnung menschlicher embryonaler Stammzellen (abgekürzt oft: hES-Zellen; h = human) nach In-vitro-Fertilisation führte zu einer hitzigen, bis heute andauernden ethischen Debatte. ⓘ
Die Verwendung von menschlichen embryonalen Stammzellen in der Forschung und Medizin wird von einem Teil der Gesellschaft abgelehnt, da zu ihrer Gewinnung die Zerstörung von frühen menschlichen Embryonen erforderlich ist („verbrauchende“ Embryonenforschung). Grundsätzlich geht es bei der Diskussion in Deutschland vor allem um die Frage, ob der frühe Embryo als menschliches Wesen unter den Würdeschutz des Grundgesetzes fällt und damit sein Leben keinerlei Abwägungen unterliegen dürfe. Die Gegner der Stammzellenforschung bemühen dabei oftmals die so genannten SKIP-Argumente, um von ihrer Position zu überzeugen. Die Befürworter der Forschung an embryonalen Stammzellen führen hingegen häufig das Argument des möglicherweise sehr hohen positiven Potentials der Forschung mit humanen embryonalen Stammzellen ins Feld: Die Wissenschaftler erhoffen sich unter anderem eine Heilung schwerer Krankheiten (Parkinson-Krankheit, Diabetes mellitus, Querschnittlähmung) sowie die Möglichkeit, zerstörte Organe nachwachsen zu lassen. Konkrete Hinweise auf solche therapeutischen Erfolge gibt es allerdings zum gegenwärtigen Zeitpunkt lediglich aus Tierexperimenten mit Nagern. ⓘ
Die Deutsche Bischofskonferenz (katholisch) vertritt die Meinung, dass menschliches Leben ab der Befruchtung der Eizelle vorliege. Dementsprechend gebühre dem Menschen ab der Befruchtung eine Würde, die eine Zerstörung der befruchteten Eizelle verbiete. Ebenso äußerte sich die Kongregation für die Glaubenslehre unter Joseph Ratzinger 1987 in der Instruktion Donum Vitae. Papst Johannes Paul II. äußerte sich u. a. hierzu in der Enzyklika Evangelium vitae 1995 und griff die entsprechenden Aspekte der Fragestellung aus Donum Vitae auf. Die päpstliche Akademie für das Leben gab 2000 eine entsprechende Erklärung heraus, die sich insbesondere mit technischen Fragen der Stammzellforschung auseinandersetzt. Eine der letzten katholischen Stellungnahmen diesbezüglich war die Erklärung Dignitas personae der Römischen Glaubenskongregation. ⓘ
Ebenso gibt es theologische Überzeugungen, dass bereits der frühe Embryo beseelt sei. Dieser Embryo habe eine Seele und stehe deshalb unter besonderem Schutz. Darauf Bezug nehmend weisen manche Befürworter der Stammzellforschung darauf hin, dass man im Anschluss an Thomas von Aquin in der katholischen Kirche bis in die Neuzeit glaubte, dass die Beseelung des Embryos schrittweise erfolge (Sukzessivbeseelung) und die höchste Form der Seele, die „anima intellectiva“, erst ca. drei Monate nach der Empfängnis übertragen werde. Endgültig hat die katholische Kirche erst in der Bulle Apostolicae Sedis (1869, unter Pius IX.) die Lehre von der vollen Menschwerdung am 80. Tag aufgegeben. ⓘ
Die evangelische Kirche hingegen möchte die Dialogfindung unterstützen, um einen Konsens in dieser Frage zu finden. Einig sind sich die Vertreter der evangelischen Kirche darüber, dass für die Isolierung embryonaler Stammzellen keine Embryonen hergestellt werden dürfen. Zur Frage der generellen Verwendung von schon bestehenden embryonalen Stammzellen hat sie bisher noch nicht Stellung bezogen; sie möchte die Grundlagenforschung an embryonalen Stammzellen „so schnell wie möglich hinter sich lassen“. ⓘ
Beim Streit um den moralischen Status des Embryos werden zusammengefasst und ergänzt unter anderem folgende Zeitpunkte diskutiert:
- Moment der Empfängnis (Kernverschmelzung)
- Differenzierung von Embryo und Plazenta
- Zeitpunkt, ab dem eine Mehrlingsbildung ausgeschlossen ist
- Nidation
- Erste Ausbildung von Hirnzellen
- Geburt
- Erste Wochen nach der Geburt ⓘ
Gesetzeslage
Europäischer Gerichtshof
Menschliche embryonale Stammzellen, für deren Gewinnung Embryonen zerstört werden müssen, so der Europäische Gerichtshof (EuGH) am 18. Oktober 2011, dürfen nicht patentiert werden, da es sich bei befruchteten Eizellen bereits um menschliches Leben handle. Mit diesem Urteil entschied der EuGH einen Patentstreit zwischen dem Neurobiologen Oliver Brüstle und Greenpeace. ⓘ
Deutschland
Nach dem Embryonenschutzgesetz ist es in Deutschland verboten, menschliche Embryonen (also auch Blastozysten, die als Quelle für embryonale Stammzellen dienen) für Forschungszwecke herzustellen, zu klonen oder zu zerstören. Die Forschung an importierten embryonalen Stammzellen ist jedoch unter Auflagen möglich und wurde zunächst durch das Stammzellgesetz vom Juli 2002 geregelt. Dieses Gesetz und insbesondere die darin enthaltene Regelung, dass nur embryonale Stammzellen nach Deutschland importiert werden durften, die vor dem 1. Januar 2002 gewonnen worden waren (Stichtagsregelung), war von Beginn an umstritten. Im Frühjahr 2008 debattierte der Deutsche Bundestag über eine Novellierung des Stammzellgesetzes, in der neben der Verschiebung des Stichtages auch die völlige Freigabe des Imports sowie das Verbot der Stammzellforschung mit embryonalen Stammzellen in Gruppenanträgen vorgeschlagen wurde. Am 11. April 2008 beschloss der Deutsche Bundestag einen neuen Stichtag, so dass nun Stammzellen importiert werden dürfen, die vor dem 1. Mai 2007 gewonnen wurden. ⓘ
Das Robert Koch-Institut führt gemäß § 11 Stammzellgesetz (StZG) ein öffentlich zugängliches Register. Dieses enthält Angaben zu genehmigten Forschungsvorhaben nach dem StZG und zu den humanen embryonalen Stammzell-Linien enthalten sind, deren Import und Verwendung genehmigt worden ist. ⓘ
Österreich
In Österreich ist die Forschung an importierten pluripotenten embryonalen Stammzellen nach geltendem Recht ohne Einschränkungen erlaubt. Dies gilt auch für das therapeutische Klonen. Verboten wäre jedoch gemäß § 9 des Fortpflanzungsmedizingesetzes die Gewinnung von embryonalen Stammzellen, sofern diese in Österreich stattfände. Die Verwendung von totipotenten Stammzellen ist nur zu Zwecken der Fortpflanzung erlaubt. ⓘ
Polen
In Polen wird die Forschung an menschlichen Embryonen bestraft, wenn diese zur Zerstörung des Embryos in vitro führt. Dies wird mit der Abtreibung gleichgesetzt und kann mit Freiheitsstrafen von bis zu drei Jahren geahndet werden. Zur Forschung mit embryonalen Stammzellen aus dem Ausland gibt es keine bindende gesetzliche Regelung. Zurzeit gilt die Richtlinie vom 13. Januar 2004; sie besagt, dass „Forschung an embryonalen Stammzellen nur dann zugelassen werden sollte, wenn sie die Rettung menschlichen Lebens zum Ziel hat.“ Hier bietet die Definition des „menschlichen Lebens“ jedoch viel Interpretationsspielraum. ⓘ
Schweiz
In der Schweiz dürfen Wissenschaftler aus überzähligen menschlichen Embryonen (das heißt aus solchen, die in der Fortpflanzungsmedizin keine Verwendung finden) Stammzellen gewinnen und mit den Zellen forschen. Der Schweizer Bundesrat verabschiedete im Februar 2005 ein entsprechendes Gesetz, nachdem sich zuvor in einer Volksabstimmung mehr als 66 Prozent der Schweizer Wähler für dieses Gesetz ausgesprochen hatten. Voraussetzung gemäß Art. 5 ff. Stammzellforschungsgesetz ist, dass die Einwilligung des Spenderpaares vorliegt, die Spende unentgeltlich erfolgt und keine der Personen, für deren Forschungsprojekt die Zellen gewonnen werden, am Fortpflanzungsverfahren beteiligt war. Das Klonen von menschlichen Zellen ist verboten. ⓘ
Großbritannien
In Großbritannien ist sowohl die Erzeugung von menschlichen embryonalen Stammzellen als auch das Klonen menschlicher Embryonen zu Forschungszwecken erlaubt. ⓘ
Vereinigte Staaten
In den USA wurde die Forschung an embryonalen Stammzellen mit öffentlichen Mitteln des Bundes bis Ende 2009 nur gefördert, wenn die verwendeten Stammzelllinien schon vor August 2001 existierten. Im Juli 2006 hatten der US-Senat und das Repräsentantenhaus zwar für eine Aufhebung dieser Einschränkung gestimmt; dagegen hat Präsident Bush jedoch sein Veto eingelegt. Für die Forschungsförderung der Bundesstaaten und für privat finanzierte Forschung hatte diese Einschränkung allerdings keine Gültigkeit. Daher konnte Kalifornien 2004 in einer Volksabstimmung beschließen, die embryonale Stammzellforschung mit drei Milliarden Dollar zu fördern. Im März 2009 hatte Präsident Obama angekündigt, dass er die Stammzellenforschung wieder mit Staatsgeldern fördern wolle. Diese Ankündigung wurde im Dezember 2009 durch die zuständigen Behörden umgesetzt, indem sie die Nutzung von zunächst 13 Linien embryonaler Stammzellen freigaben. Im August 2010 wurde diese Förderung von einem US-Gericht wieder blockiert, da sie gegen ein Gesetz verstoße, das die Zerstörung menschlicher Embryonen verbietet. ⓘ
Stammzellengewinnung aus dem Zahnmark der Milchzähne
Das Milchzahngebiss eignet sich als Quelle der Stammzellengewinnung. Die im Zahnmark befindlichen Zellen können extrahiert, mit einem speziellen Wachstumsmittel kultiviert und schließlich für medizinisch Zwecke konserviert werden. Die Stammzellen können in der Zahnmedizin für die Regeneration der dentalen Pulpa bei Erwachsenen eingesetzt werden. Mithilfe einer Verpflanzung von Stammzellen im Rahmen eines Tissue Engineerings können sich Teile der Wurzelkanäle wieder erneuern. ⓘ