Salpetersäure

| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Salpetersäure
| |||
| Andere Bezeichnungen
Aqua fortis, Spiritus von Niter, Eau forte, Wasserstoffnitrat, Acidum nitricum
| |||
| Bezeichnungen | |||
3D-Modell (JSmol)
|
|||
| 3DMet | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin-Referenz
|
1576 | ||
| KEGG | |||
| MeSH | Stickstoff+Säure | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 2031 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
HNO3 | ||
| Molekulare Masse | 63,012 g-mol-1 | ||
| Erscheinungsbild | Farblose Flüssigkeit | ||
| Geruch | ätzend, erstickend | ||
| Dichte | 1,51 g/cm3, 1,41 g/cm3 [68% w/w] | ||
| Schmelzpunkt | -42 °C (-44 °F; 231 K) | ||
| Siedepunkt | 83 °C (181 °F; 356 K) 68%ige Lösung siedet bei 121 °C (250 °F; 394 K) | ||
Löslichkeit in Wasser
|
mischbar | ||
| log P | −0.13 | ||
| Dampfdruck | 48 mmHg (20 °C) | ||
| Acidität (pKa) | −1.4 | ||
| Konjugierte Base | Nitrat | ||
Magnetische Suszeptibilität (χ)
|
-1,99×10-5 cm3/mol | ||
Brechungsindex (nD)
|
1.397 (16.5 °C) | ||
Dipolmoment
|
2.17 ± 0.02 D | ||
| Thermochemie | |||
Std. molare
Entropie (S |
146 J/(mol-K) | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-207 kJ/mol | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
 
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H272, H300, H310, H330, H373, H411 | ||
Sicherheitshinweise
|
P210, P220, P260, P305+P351+P338, P310, P370+P378 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | Nicht brennbar | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LC50 (mittlere Konzentration)
|
138 ppm (Ratte, 30 min) | ||
| NIOSH (US-Grenzwerte für die Gesundheitsgefährdung): | |||
PEL (Zulässig)
|
TWA 2 ppm (5 mg/m3) | ||
REL (Empfohlen)
|
TWA 2 ppm (5 mg/m3) ST 4 ppm (10 mg/m3) | ||
IDLH (Unmittelbare Gefahr)
|
25 ppm | ||
| Sicherheitsdatenblatt (SDS) | ICSC 0183 | ||
| Verwandte Verbindungen | |||
Andere Anionen
|
Salpetrige Säure | ||
Andere Kationen
|
Natriumnitrat Kaliumnitrat Ammoniumnitrat | ||
Verwandte Verbindungen
|
Distickstofftrioxid Distickstofftetroxid Distickstoffpentoxid Stickstoffoxid Stickstoffmonoxid Stickstoffdioxid | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Stoffe in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Salpetersäure ist eine anorganische Verbindung mit der Formel HNO3. Sie ist eine stark ätzende Mineralsäure. Die Verbindung ist farblos, aber ältere Proben neigen aufgrund der Zersetzung in Stickstoffoxide zu einem Gelbstich. Die meisten im Handel erhältlichen Salpetersäuren haben eine Konzentration von 68 % in Wasser. Enthält die Lösung mehr als 86 % HNO3, wird sie als rauchende Salpetersäure bezeichnet. Je nach der Menge des vorhandenen Stickstoffdioxids wird rauchende Salpetersäure bei Konzentrationen über 86 % als rot rauchende Salpetersäure und bei Konzentrationen über 95 % als weiß rauchende Salpetersäure bezeichnet. ⓘ
Salpetersäure ist das Hauptreagenz für die Nitrierung, d. h. die Anfügung einer Nitrogruppe, in der Regel an ein organisches Molekül. Während einige der entstehenden Nitroverbindungen stoß- und wärmeempfindliche Sprengstoffe sind, sind andere stabil genug, um in Munition und Sprengstoffen verwendet zu werden, während wieder andere stabiler sind und als Pigmente in Tinten und Farbstoffen eingesetzt werden. Salpetersäure wird auch häufig als starkes Oxidationsmittel verwendet. ⓘ
| Strukturformel ⓘ | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
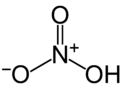
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Salpetersäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | HNO3 | |||||||||||||||
| Kurzbeschreibung |
in reiner Form farblose Flüssigkeit, durch Licht oder Wärme teilweise Zersetzung zu Stickoxiden unter Gelb- bis Rotfärbung | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 63,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,51 g·cm−3 (20 °C) | |||||||||||||||
| Schmelzpunkt |
−42 °C | |||||||||||||||
| Siedepunkt |
86 °C | |||||||||||||||
| Dampfdruck |
56 hPa (20 °C) | |||||||||||||||
| pKS-Wert |
−1,37 | |||||||||||||||
| Löslichkeit |
mit Wasser in jedem Verhältnis mischbar, heftige Reaktion mit Ethanol | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
| |||||||||||||||
| Toxikologische Daten |
430 mg·kg−1 (LDLo, Mensch, oral) | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Salpetersäure (HNO3), genannt auch Scheidewasser, ist die bekannteste und stabilste Sauerstoffsäure des Stickstoffs. Die Säure wird seit 1908 großtechnisch im Ostwald-Verfahren durch katalytische Oxidation von Ammoniak hergestellt. Das Ammoniak wird zuvor mit dem Haber-Bosch-Verfahren aus Luftstickstoff und Wasserstoff hergestellt. ⓘ
Die Salze der Salpetersäure heißen Nitrate. Der Name Salpetersäure leitet sich von den Trivialnamen einiger Alkali- und Erdalkalisalze der Säure ab, die mit der Bezeichnung Salpeter enden wie z. B.: Natriumnitrat (Chilesalpeter), Kaliumnitrat (Kalisalpeter), Ammoniumnitrat (Ammonsalpeter), Calciumnitrat (Kalksalpeter oder Mauersalpeter), Bariumnitrat (Barytsalpeter). Bis 1908 wurde Salpetersäure aus den verschiedenen Salpetersorten durch Zugabe einer starken, schwer flüchtigen Säure (Schwefelsäure) gewonnen. Der Name der Salze der Salpetersäure Nitrate wird sehr häufig auch benutzt, um einige organische Verbindungen der Salpetersäure – nämlich die Ester der Salpetersäure – zu benennen. So wird z. B. der Methylester der Salpetersäure als Methylnitrat bezeichnet (s. dazu auch Nitrate), obwohl in den Estern völlig andere Bindungsverhältnisse vorliegen als in Salzen. Erschwerend und die Verwirrung noch erhöhend kommt hinzu, dass einige spezielle Ester der Salpetersäure in der Umgangssprache weder richtig als Ester noch falsch als Nitrate bezeichnet werden, sondern als sog. Nitroverbindungen, wie z. B. Nitroglycerin (richtige Benennung: Trisalpetersäureglycerinester) oder Nitrocellulose oder Cellulosenitrat. ⓘ
Als starke anorganische Säure liegt die Salpetersäure in wässriger Lösung weitgehend dissoziiert vor und zählt zu den Mineralsäuren. Die reine Säure ist farblos und hat einen scharf stechenden Geruch. Sie wird unter anderem zur Herstellung von Düngemitteln, Farb- und Sprengstoffen verwendet. ⓘ
Physikalische und chemische Eigenschaften
Handelsübliche Salpetersäure ist ein Azeotrop mit Wasser in einer Konzentration von 68 % HNO3. Diese Lösung hat eine Siedetemperatur von 120,5 °C (249 °F) bei 1 atm. Sie wird als "konzentrierte Salpetersäure" bezeichnet. Das Azeotrop aus Salpetersäure und Wasser ist bei Raumtemperatur eine farblose Flüssigkeit. ⓘ
Es sind zwei feste Hydrate bekannt: das Monohydrat HNO3-H2O oder Oxoniumnitrat [H3O]+[NO3]- und das Trihydrat HNO3-3H2O. ⓘ
Gelegentlich ist eine ältere Dichteskala zu sehen, bei der konzentrierte Salpetersäure mit 42 Baumé angegeben ist. ⓘ
Verunreinigung mit Stickstoffdioxid

Salpetersäure kann sich thermisch oder durch Licht zersetzen und wurde deshalb oft in Braunglasflaschen aufbewahrt:
- 4 HNO3 → 2 H2O + 4 NO2 + O2
Diese Reaktion kann zu nicht vernachlässigbaren Schwankungen des Dampfdrucks über der Flüssigkeit führen, da sich die entstehenden Stickoxide teilweise oder vollständig in der Säure lösen. ⓘ
Das Stickstoffdioxid (NO2) und/oder Distickstofftetroxid (N2O4) bleibt in der Salpetersäure gelöst und färbt sie bei höheren Temperaturen gelb oder sogar rot. Während die reine Säure an der Luft in der Regel weiße Dämpfe abgibt, entstehen bei Säure mit gelöstem Stickstoffdioxid rötlich-braune Dämpfe, was zu den gebräuchlichen Bezeichnungen "rot rauchende Salpetersäure" und "weiß rauchende Salpetersäure" führt. Stickstoffoxide (NOx) sind in Salpetersäure löslich. ⓘ
Rauchende Salpetersäure
Rauchende Salpetersäure in handelsüblicher Qualität enthält 98 % HNO3 und hat eine Dichte von 1,50 g/cm3. Diese Qualität wird häufig in der Sprengstoffindustrie verwendet. Sie ist weder so flüchtig noch so ätzend wie die wasserfreie Säure und hat eine ungefähre Konzentration von 21,4 M. ⓘ
Rote rauchende Salpetersäure (RFNA) enthält beträchtliche Mengen an gelöstem Stickstoffdioxid (NO2), wodurch die Lösung eine rötlich-braune Farbe annimmt. Aufgrund des gelösten Stickstoffdioxids ist die Dichte der roten rauchenden Salpetersäure mit 1,490 g/cm3 geringer. ⓘ
Eine inhibierte rauchende Salpetersäure, entweder Weiße inhibierte rauchende Salpetersäure (IWFNA) oder Rote inhibierte rauchende Salpetersäure (IRFNA), kann durch den Zusatz von 0,6 bis 0,7 % Fluorwasserstoff (HF) hergestellt werden. Dieses Fluorid wird für die Korrosionsbeständigkeit in Metalltanks zugesetzt. Das Fluorid bildet eine Metallfluoridschicht, die das Metall schützt. ⓘ
Wasserfreie Salpetersäure
Weiß rauchende Salpetersäure, reine Salpetersäure oder WFNA, ist der wasserfreien Salpetersäure sehr ähnlich. Sie ist als 99,9-prozentige Salpetersäure im Handel erhältlich. Eine Spezifikation für weiß rauchende Salpetersäure lautet, dass sie maximal 2 % Wasser und maximal 0,5 % gelöstes NO2 enthält. Wasserfreie Salpetersäure hat eine Dichte von 1,513 g/cm3 und eine ungefähre Konzentration von 24 molar. Wasserfreie Salpetersäure ist eine farblose mobile Flüssigkeit mit einer Dichte von 1,512 g/cm3, die bei -42 °C (-44 °F) zu weißen Kristallen erstarrt. Bei der Zersetzung zu NO2 und Wasser erhält sie eine gelbe Färbung. Es siedet bei 83 °C (181 °F). Gewöhnlich wird es in einer bruchsicheren Braunglasflasche mit doppeltem Fassungsvermögen gelagert, um einen Druckaufbau zu ermöglichen, aber selbst mit diesen Vorkehrungen muss die Flasche monatlich entlüftet werden, um den Druck abzulassen. ⓘ
Struktur und Bindung

Zwei der N-O-Bindungen sind äquivalent und relativ kurz (dies lässt sich durch Resonanztheorien erklären; die kanonischen Formen weisen in diesen beiden Bindungen Doppelbindungscharakter auf, wodurch sie kürzer als typische N-O-Bindungen sind), und die dritte N-O-Bindung ist verlängert, da das O-Atom auch an ein Proton gebunden ist. ⓘ
Reaktionen
Säure-Base-Eigenschaften
Salpetersäure gilt normalerweise als starke Säure bei Raumtemperatur. Über den Wert der Säuredissoziationskonstante herrscht Uneinigkeit, der pKa-Wert wird jedoch in der Regel mit weniger als -1 angegeben. Dies bedeutet, dass die Salpetersäure in verdünnter Lösung vollständig dissoziiert ist, außer in extrem sauren Lösungen. Der pKa-Wert steigt bei einer Temperatur von 250 °C auf 1 an. ⓘ
Salpetersäure kann im Verhältnis zu einer Säure wie Schwefelsäure als Base wirken:
- HNO3 + 2 H2SO4 ⇌ NO+2 + H3O+ + 2 HSO-4; Gleichgewichtskonstante: K ≈ 22
Das Nitronium-Ion, NO+2, ist das aktive Reagenz bei aromatischen Nitrierungsreaktionen. Da Salpetersäure sowohl saure als auch basische Eigenschaften hat, kann sie eine Autoprotolysereaktion eingehen, ähnlich wie die Selbstionisierung von Wasser:
- 2 HNO3 ⇌ NO+2 + NO-3 + H2O ⓘ
Reaktionen mit Metallen
Salpetersäure reagiert mit den meisten Metallen, aber die Einzelheiten hängen von der Konzentration der Säure und der Art des Metalls ab. Verdünnte Salpetersäure verhält sich bei ihrer Reaktion mit den meisten Metallen wie eine typische Säure. Magnesium, Mangan und Zink setzen H2 frei:
- Mg + 2 HNO3 → Mg(NO3)2 (Magnesiumnitrat) + H2
- Mn + 2 HNO3 → Mn(NO3)2 (Mangan(II)nitrat) + H2 ⓘ
Salpetersäure kann nicht aktive Metalle wie Kupfer und Silber oxidieren. Bei diesen nicht aktiven oder weniger elektropositiven Metallen hängen die Produkte von der Temperatur und der Säurekonzentration ab. Zum Beispiel reagiert Kupfer mit verdünnter Salpetersäure bei Umgebungstemperatur mit einer 3:8-Stöchiometrie:
- 3 Cu + 8 HNO3 → 3 Cu2+ + 2 NO + 4 H2O + 6 NO-3
Das entstehende Stickstoffoxid kann mit Luftsauerstoff zu Stickstoffdioxid reagieren. Mit konzentrierterer Salpetersäure wird Stickstoffdioxid direkt in einer Reaktion mit einer Stöchiometrie von 1:4 erzeugt:
- Cu + 4 H+ + 2 NO-3 → Cu2+ + 2 NO2 + 2 H2O ⓘ
Bei der Reaktion mit Salpetersäure bilden die meisten Metalle die entsprechenden Nitrate. Einige Metalloide und Metalle ergeben die Oxide; so werden beispielsweise Sn, As, Sb und Ti zu SnO2, As2O5, Sb2O5 bzw. TiO2 oxidiert. ⓘ
Einige Edelmetalle, wie z. B. reines Gold und Platingruppenmetalle, reagieren nicht mit Salpetersäure, obwohl reines Gold mit Königswasser, einer Mischung aus konzentrierter Salpetersäure und Salzsäure, reagiert. Einige weniger edle Metalle (Ag, Cu, ...), die in einigen goldarmen Goldlegierungen enthalten sind, wie z. B. Farbgold, können jedoch leicht durch Salpetersäure oxidiert und aufgelöst werden, was zu Farbveränderungen an der Oberfläche der Goldlegierung führt. Salpetersäure wird in Juweliergeschäften als billiges Mittel eingesetzt, um goldarme Legierungen (< 14 Karat) schnell zu erkennen und die Goldreinheit schnell zu bestimmen. ⓘ
Da Salpetersäure ein starkes Oxidationsmittel ist, reagiert sie mit vielen nichtmetallischen Verbindungen, manchmal sogar explosiv. Je nach Säurekonzentration, Temperatur und dem beteiligten Reduktionsmittel können die Endprodukte unterschiedlich ausfallen. Die Reaktion findet mit allen Metallen außer den Edelmetallreihen und bestimmten Legierungen statt. In der Regel treten oxidierende Reaktionen vor allem mit der konzentrierten Säure auf, was die Bildung von Stickstoffdioxid (NO2) begünstigt. Die starken oxidierenden Eigenschaften der Salpetersäure sind jedoch thermodynamischer Natur, aber manchmal sind ihre Oxidationsreaktionen eher kinetisch ungünstig. Die Anwesenheit kleiner Mengen salpetriger Säure (HNO2) erhöht die Reaktionsgeschwindigkeit erheblich. ⓘ
Obwohl sich Chrom (Cr), Eisen (Fe) und Aluminium (Al) in verdünnter Salpetersäure leicht auflösen, bildet die konzentrierte Säure eine Metalloxidschicht, die den Großteil des Metalls vor weiterer Oxidation schützt. Die Bildung dieser Schutzschicht wird als Passivierung bezeichnet. Typische Passivierungskonzentrationen liegen zwischen 20 und 50 Volumenprozent (siehe ASTM A967-05). Metalle, die durch konzentrierte Salpetersäure passiviert werden, sind Eisen, Kobalt, Chrom, Nickel und Aluminium. ⓘ
Reaktionen mit Nicht-Metallen
Als starke oxidierende Säure reagiert Salpetersäure mit vielen organischen Stoffen, und die Reaktionen können explosiv sein. Die Hydroxylgruppe entzieht dem organischen Molekül in der Regel einen Wasserstoff und bildet Wasser, und die verbleibende Nitrogruppe nimmt den Platz des Wasserstoffs ein. Die Nitrierung organischer Verbindungen mit Salpetersäure ist die wichtigste Methode zur Synthese vieler gängiger Sprengstoffe wie Nitroglycerin und Trinitrotoluol (TNT). Da sehr viele weniger stabile Nebenprodukte entstehen können, müssen diese Reaktionen sorgfältig thermisch kontrolliert und die Nebenprodukte entfernt werden, um das gewünschte Produkt zu isolieren. ⓘ
Bei der Reaktion mit nichtmetallischen Elementen, mit Ausnahme von Stickstoff, Sauerstoff, Edelgasen, Silicium und Halogenen mit Ausnahme von Jod, werden diese in der Regel bis zu ihrer höchsten Oxidationsstufe als Säuren oxidiert, wobei bei konzentrierter Säure Stickstoffdioxid und bei verdünnter Säure Stickstoffoxid gebildet wird. ⓘ
- C (Graphit) + 4 HNO3 → CO2 + 4 NO2 + 2 H2O
- 3 C (Graphit) + 4 HNO3 → 3 CO2 + 4 NO + 2 H2O ⓘ
Konzentrierte Salpetersäure oxidiert I2, P4 und S8 zu HIO3, H3PO4 bzw. H2SO4. Obwohl sie mit Graphit und amorphem Kohlenstoff reagiert, reagiert sie nicht mit Diamant; sie kann Diamant von dem Graphit, den sie oxidiert, abtrennen. ⓘ
Xanthoprotein-Test
Salpetersäure reagiert mit Proteinen und bildet gelbe Nitrierungsprodukte. Diese Reaktion wird als Xanthoprotein-Reaktion bezeichnet. Bei diesem Test wird der zu untersuchenden Substanz konzentrierte Salpetersäure zugesetzt und das Gemisch anschließend erhitzt. Wenn Proteine vorhanden sind, die Aminosäuren mit aromatischen Ringen enthalten, färbt sich das Gemisch gelb. Bei Zugabe einer Base, wie z. B. Ammoniak, wird die Farbe orange. Diese Farbveränderungen werden durch nitrierte aromatische Ringe im Protein verursacht. Xanthoproteinsäure wird gebildet, wenn die Säure mit Epithelzellen in Kontakt kommt. Entsprechende lokale Farbveränderungen der Haut sind ein Hinweis auf unzureichende Sicherheitsvorkehrungen beim Umgang mit Salpetersäure. ⓘ
Herstellung
Salpetersäure wird durch Reaktion von Stickstoffdioxid (NO2) mit Wasser hergestellt. ⓘ
- 4 NO2 + 2 H2O → 2 HNO3 + NO + NO2 + H2O ⓘ
Die Nettoreaktion ist:
- 3 NO2 + H2O → 2 HNO3 + NO ⓘ
Normalerweise wird das bei der Reaktion entstehende Stickoxid durch den Sauerstoff der Luft reoxidiert, wobei zusätzliches Stickstoffdioxid entsteht. ⓘ
Die Durchmischung von Stickstoffdioxid mit Wasserstoffperoxid kann dazu beitragen, die Säureausbeute zu verbessern. ⓘ
- 2 NO2 + H2O2 → 2 HNO3 ⓘ
Handelsübliche Salpetersäurelösungen enthalten in der Regel zwischen 52 % und 68 % Salpetersäure. Die Herstellung von Salpetersäure erfolgt nach dem Ostwald-Verfahren, benannt nach dem deutschen Chemiker Wilhelm Ostwald. Bei diesem Verfahren wird wasserfreies Ammoniak in Gegenwart eines Platin- oder Rhodiumnetz-Katalysators bei einer hohen Temperatur von etwa 500 K (227 °C; 440 °F) und einem Druck von 9 Standardatmosphären (910 kPa) zu Stickstoffoxid oxidiert. ⓘ
- 4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(g) (ΔH = -905,2 kJ/mol) ⓘ
Stickstoffoxid reagiert dann mit Sauerstoff in der Luft zu Stickstoffdioxid. ⓘ
- 2 NO(g) + O2(g) → 2 NO2(g) (ΔH = -114 kJ/mol) ⓘ
Dieses wird anschließend in Wasser absorbiert und bildet Salpetersäure und Stickstoffoxid. ⓘ
- 3 NO2(g) + H2O(l) → 2 HNO3(aq) + NO(g) (ΔH = -135,74 kJ/mol) ⓘ
Das Stickstoffmonoxid wird zur Reoxidation zurückgeführt. Alternativ kann der letzte Schritt auch an der Luft durchgeführt werden:
- 4 NO2(g) + O2(g) + 2 H2O(l) → 4 HNO3(aq) ⓘ
Das erhaltene wässrige HNO3 kann durch Destillation auf etwa 68 Masseprozent aufkonzentriert werden. Eine weitere Aufkonzentrierung auf 98 % kann durch Dehydratisierung mit konzentrierter H2SO4 erreicht werden. Durch die Verwendung von Ammoniak aus dem Haber-Verfahren kann das Endprodukt aus Stickstoff, Wasserstoff und Sauerstoff hergestellt werden, die als einzige Ausgangsstoffe aus Luft und Erdgas gewonnen werden. ⓘ
Synthese im Labor
Im Labor kann Salpetersäure durch thermische Zersetzung von Kupfer(II)-nitrat hergestellt werden, wobei Stickstoffdioxid und Sauerstoff entstehen, die dann durch Wasser geleitet werden und Salpetersäure ergeben. ⓘ
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
Dann folgt der Ostwald-Prozess:
- 2 NO2 + H2O → HNO2 + HNO3 ⓘ
Oder die Reaktion von gleichen Molen eines beliebigen Nitratsalzes, z. B. Natriumnitrat, mit Schwefelsäure (H2SO4) und Destillation dieses Gemischs bei dem Siedepunkt der Salpetersäure von 83 °C. Im Destillationsgefäß verbleibt ein nichtflüchtiger Rückstand des Metallhydrogensulfats. Die erhaltene rot rauchende Salpetersäure kann in die weiße Salpetersäure umgewandelt werden. ⓘ
- NaNO3 + H2SO4 → HNO3 + NaHSO4 ⓘ
Das gelöste NOx lässt sich bei Raumtemperatur unter vermindertem Druck (10-30 Minuten bei 200 mmHg oder 27 kPa) leicht entfernen, wobei weiße rauchende Salpetersäure entsteht. Dieses Verfahren kann auch unter reduziertem Druck und bei reduzierter Temperatur in einem Schritt durchgeführt werden, um weniger Stickstoffdioxidgas zu erzeugen. ⓘ
Verdünnte Salpetersäure kann durch Destillation bis zu 68 % Säure konzentriert werden, was einem maximal siedenden Azeotrop entspricht. Im Labor erfolgt die weitere Konzentration durch Destillation mit Schwefelsäure oder Magnesiumnitrat, die als Trocknungsmittel dienen. Solche Destillationen müssen in Ganzglasapparaturen bei reduziertem Druck durchgeführt werden, um eine Zersetzung der Säure zu verhindern. Industriell wird hochkonzentrierte Salpetersäure durch Auflösen von zusätzlichem Stickstoffdioxid in 68%iger Salpetersäure in einem Absorptionsturm hergestellt. Gelöste Stickoxide werden entweder im Fall von weiß rauchender Salpetersäure abgetrennt oder verbleiben in Lösung, um rot rauchende Salpetersäure zu bilden. In jüngerer Zeit wurden elektrochemische Verfahren zur Herstellung von wasserfreier Säure aus konzentrierter Salpetersäure entwickelt. ⓘ
Verwendungen

Die wichtigste industrielle Verwendung von Salpetersäure ist die Herstellung von Düngemitteln. Salpetersäure wird mit Ammoniak neutralisiert, um Ammoniumnitrat zu erhalten. Für diese Anwendung werden 75-80 % der jährlich produzierten 26 Millionen Tonnen (1987) verbraucht. Die anderen Hauptanwendungen sind die Herstellung von Sprengstoffen, Nylonvorprodukten und speziellen organischen Verbindungen. ⓘ
Vorläufer für organische Stickstoffverbindungen
In der industriellen und sonstigen organischen Synthese ist die Nitrogruppe eine vielseitige funktionelle Gruppe. Ein Gemisch aus Salpeter- und Schwefelsäure führt durch elektrophile aromatische Substitution einen Nitro-Substituenten in verschiedene aromatische Verbindungen ein. Viele Sprengstoffe, wie z. B. TNT, werden auf diese Weise hergestellt:
- C6H5CH3 + 3 HNO3 → C6H2(NO2)3CH3 + 3 H2O ⓘ
Das überschüssige Wasser wird entweder mit konzentrierter Schwefelsäure oder mit Oleum absorbiert. ⓘ
Die Nitrogruppe kann zu einer Amingruppe reduziert werden, was die Synthese von Anilinverbindungen aus verschiedenen Nitrobenzolen ermöglicht:
Verwendung als Oxidationsmittel
Der Vorläufer von Nylon, Adipinsäure, wird in großem Maßstab durch Oxidation von "KA-Öl" - einer Mischung aus Cyclohexanon und Cyclohexanol - mit Salpetersäure hergestellt. ⓘ
Raketentreibstoff
Salpetersäure wurde in verschiedenen Formen als Oxidationsmittel in Flüssigtreibstoffraketen verwendet. Zu diesen Formen gehören rote rauchende Salpetersäure, weiße rauchende Salpetersäure, Mischungen mit Schwefelsäure und diese Formen mit HF-Inhibitor. IRFNA (inhibierte rot rauchende Salpetersäure) war eine der drei flüssigen Treibstoffkomponenten für die BOMARC-Rakete. ⓘ
Nischenanwendungen
Metallverarbeitung
Salpetersäure kann zur Umwandlung von Metallen in oxidierte Formen verwendet werden, z. B. zur Umwandlung von Kupfermetall in Kupfernitrat. Sie kann auch in Kombination mit Salzsäure als Königswasser verwendet werden, um Edelmetalle wie Gold (als Chloroursäure) aufzulösen. Diese Salze können zur Reinigung von Gold und anderen Metallen mit einem Reinheitsgrad von über 99,9 % durch Umkristallisation und selektive Ausfällung verwendet werden. Ihre Fähigkeit, bestimmte Metalle selektiv zu lösen oder als Lösungsmittel für viele Metallsalze zu fungieren, macht sie für Goldspaltungsprozesse nützlich. ⓘ
Analytisches Reagenz
Bei der Elementaranalyse mittels ICP-MS, ICP-AES, GFAA und Flame AA wird verdünnte Salpetersäure (0,5-5,0 %) als Matrixverbindung zur Bestimmung von Metallspuren in Lösungen verwendet. Für eine solche Bestimmung ist hochreine Säure in Spurenmetallqualität erforderlich, da geringe Mengen an Metallionen das Ergebnis der Analyse beeinträchtigen könnten. ⓘ
Sie wird auch typischerweise beim Aufschluss von trüben Wasserproben, Schlammproben, festen Proben sowie anderen Arten einzigartiger Proben verwendet, die eine Elementaranalyse mittels ICP-MS, ICP-OES, ICP-AES, GFAA und Flammen-Atomabsorptionsspektroskopie erfordern. Für diese Aufschlüsse wird in der Regel eine 50%ige Lösung des gekauften HNO3 gemischt mit DI-Wasser Typ 1 verwendet. ⓘ
In der Elektrochemie wird Salpetersäure als chemisches Dotiermittel für organische Halbleiter und in Reinigungsprozessen für rohe Kohlenstoff-Nanoröhren verwendet. ⓘ
Holzbearbeitung
In geringer Konzentration (etwa 10 %) wird Salpetersäure häufig zur künstlichen Alterung von Kiefern- und Ahornholz verwendet. Dabei entsteht eine grau-goldene Farbe, die sehr stark an sehr altes, mit Wachs oder Öl behandeltes Holz erinnert (Holzveredelung). ⓘ
Ätzmittel und Reinigungsmittel
Die ätzende Wirkung von Salpetersäure wird für einige Spezialanwendungen genutzt, z. B. zum Ätzen in der Druckindustrie, zum Beizen von Edelstahl oder zum Reinigen von Siliziumscheiben in der Elektronik. ⓘ
Eine Lösung aus Salpetersäure, Wasser und Alkohol, Nital, wird zum Ätzen von Metallen verwendet, um das Mikrogefüge freizulegen. ISO 14104 ist eine der Normen, in denen dieses bekannte Verfahren beschrieben wird. ⓘ
Salpetersäure wird entweder in Kombination mit Salzsäure oder allein zur Reinigung von Deckgläsern und Objektträgern für anspruchsvolle Mikroskopieanwendungen verwendet. Sie wird auch zur Reinigung von Glas vor der Versilberung bei der Herstellung von Silberspiegeln verwendet. ⓘ
Im Handel erhältliche wässrige Mischungen aus 5-30 % Salpetersäure und 15-40 % Phosphorsäure werden üblicherweise für die Reinigung von Geräten in der Lebensmittel- und Milchwirtschaft verwendet, vor allem um ausgefällte Kalzium- und Magnesiumverbindungen zu entfernen (die sich entweder aus dem Prozessstrom abgesetzt haben oder durch die Verwendung von hartem Wasser während der Produktion und Reinigung entstanden sind). Der Phosphorsäuregehalt trägt dazu bei, Eisenlegierungen gegen Korrosion durch die verdünnte Salpetersäure zu passivieren. ⓘ
Salpetersäure kann als Stichprobe für Alkaloide wie LSD verwendet werden, wobei sich je nach Alkaloid unterschiedliche Farben ergeben. ⓘ
Wiederaufbereitung von Kernbrennstoffen
Salpetersäure spielt eine Schlüsselrolle bei PUREX und anderen Verfahren zur Wiederaufbereitung von Kernbrennstoffen, wo sie viele verschiedene Aktinide auflösen kann. Die dabei entstehenden Nitrate werden in verschiedene Komplexe umgewandelt, die selektiv umgesetzt und extrahiert werden können, um die Metalle voneinander zu trennen. ⓘ
Sicherheit
Salpetersäure ist eine ätzende Säure und ein starkes Oxidationsmittel. Die größte Gefahr, die von ihr ausgeht, sind Verätzungen, da sie mit Proteinen (Amid) und Fetten (Ester) eine Säurehydrolyse durchführt, die in der Folge lebendes Gewebe (z. B. Haut und Fleisch) zersetzt. Konzentrierte Salpetersäure färbt die menschliche Haut aufgrund ihrer Reaktion mit dem Keratin gelb. Diese gelben Flecken verfärben sich orange, wenn sie neutralisiert werden. Systemische Auswirkungen sind unwahrscheinlich, und die Substanz gilt nicht als krebserregend oder mutagen. ⓘ
Die Standard-Erste-Hilfe-Maßnahme bei Säureflecken auf der Haut ist, wie bei anderen ätzenden Stoffen, das Abspülen mit großen Mengen Wasser. Die Spülung wird mindestens 10-15 Minuten lang fortgesetzt, um das die Verätzung umgebende Gewebe zu kühlen und Folgeschäden zu vermeiden. Die kontaminierte Kleidung wird sofort ausgezogen und die darunter liegende Haut gründlich gewaschen. ⓘ
Da Salpetersäure ein starkes Oxidationsmittel ist, kann sie mit vielen Verbindungen heftig reagieren. ⓘ
Einsatz bei Säureangriffen
Salpetersäure ist eine der am häufigsten bei Säureangriffen verwendeten Säuren. ⓘ
Geschichte
Salpetersäure wird erstmals in Pseudo-Gebers De inventione veritatis ("Über die Entdeckung der Wahrheit") (nach ca. 1300) erwähnt. Sie wurde auch in Werken beschrieben, die Albert dem Großen und Ramon Lull zugeschrieben werden, der sie durch Destillation einer Mischung aus Niter und grünem Vitriol herstellte und sie "eau forte" (aqua fortis) nannte. ⓘ
Im 17. Jahrhundert entwickelte Johann Rudolf Glauber ein Verfahren zur Gewinnung von Salpetersäure durch Destillation von Kaliumnitrat mit Schwefelsäure. 1776 zitierte Antoine Lavoisier die Arbeit von Joseph Priestley, um darauf hinzuweisen, dass Salpetersäure aus Stickstoffoxid (das er als "salpetrige Luft" bezeichnete) in Verbindung mit einem ungefähr gleichen Volumen des reinsten Teils der gewöhnlichen Luft und einer beträchtlichen Menge Wasser hergestellt werden kann. Im Jahr 1785 bestimmte Henry Cavendish die genaue Zusammensetzung des Stickstoffs und zeigte, dass er synthetisiert werden kann, indem ein Strom elektrischer Funken durch feuchte Luft geleitet wird. 1806 berichtete Humphry Davy über die Ergebnisse umfangreicher Experimente zur Elektrolyse von destilliertem Wasser und kam zu dem Schluss, dass Salpetersäure an der Anode aus gelöstem atmosphärischem Stickstoffgas erzeugt wird. Er verwendete eine Hochspannungsbatterie und nicht reaktive Elektroden und Gefäße wie Goldelektrodenkegel, die gleichzeitig als Gefäße dienten, die mit feuchtem Asbest überbrückt waren. ⓘ
Die industrielle Herstellung von Salpetersäure aus atmosphärischer Luft begann 1905 mit dem Birkeland-Eyde-Verfahren, das auch als Lichtbogenverfahren bekannt ist. Dieses Verfahren basiert auf der Oxidation von atmosphärischem Stickstoff durch Luftsauerstoff zu Stickstoffoxid mit einem elektrischen Lichtbogen bei sehr hoher Temperatur. Bei 3000 °C wurden Ausbeuten von bis zu etwa 4-5 % Stickstoffoxid erzielt, bei niedrigeren Temperaturen weniger. Das Stickoxid wurde abgekühlt und durch den verbleibenden Luftsauerstoff zu Stickstoffdioxid oxidiert, das anschließend in einer Reihe von Absorptionstürmen mit Füllkörperkolonnen oder Plattenkolonnen in Wasser absorbiert wurde, um verdünnte Salpetersäure herzustellen. In den ersten Türmen wurde das Stickstoffdioxid in Blasen durch Wasser und nicht reaktive Quarzsplitter geleitet. Etwa 20 % der erzeugten Stickoxide blieben unumgesetzt, so dass die letzten Türme eine Alkalilösung enthielten, um den Rest zu neutralisieren. Das Verfahren war sehr energieintensiv und wurde schnell durch das Ostwald-Verfahren verdrängt, als billiges Ammoniak verfügbar wurde. ⓘ
Eine weitere frühe Produktionsmethode wurde um 1913 vom französischen Ingenieur Albert Nodon erfunden. Seine Methode erzeugte Salpetersäure durch Elektrolyse von Kalziumnitrat, das von Bakterien aus stickstoffhaltigem Material in Torfmooren umgewandelt wurde. Ein von Kalkstein umgebener Tontopf wurde in den Torf versenkt und mit geteerten Hölzern abgesteckt, um einen Raum für die Kohlenstoffanode zu schaffen, um die sich die Salpetersäure bildet. Die Salpetersäure wurde aus einem Steingutrohr abgepumpt, das bis zum Boden des Topfes hinuntergelassen wurde. Durch ein weiteres Steingutrohr wurde frisches Wasser nach oben gepumpt, um die entnommene Flüssigkeit zu ersetzen. Der Innenraum wurde mit Koks gefüllt. Die gusseisernen Kathoden wurden in den umgebenden Torf versenkt. Der Widerstand betrug etwa 3 Ohm pro Kubikmeter und die gelieferte Spannung lag bei etwa 10 Volt. Die Produktion aus einer Lagerstätte betrug 800 Tonnen pro Jahr. ⓘ
Nach der Einführung des Haber-Verfahrens zur effizienten Herstellung von Ammoniak im Jahr 1913 überholte die Salpetersäureproduktion aus Ammoniak nach dem Ostwald-Verfahren die Produktion nach dem Birkeland-Eyde-Verfahren. Diese Produktionsmethode wird auch heute noch angewandt. ⓘ
In der Schrift De inventione veritatis aus dem 12. Jahrhundert wird erwähnt, dass bereits im 9. Jahrhundert der arabische Alchimist Geber rohe Salpetersäure („Aqua dissolutiva“) durch trockenes Erhitzen von Salpeter (lat. sal petrae = Felsensalz; KNO3), Cyprischem Vitriol (CuSO4·5 H2O) und Alaun (KAl(SO4)2·12 H2O) gewonnen haben soll. Im 13. Jahrhundert soll Albertus Magnus die Salpetersäure benutzt haben, um Gold und Silber zu trennen (Scheidewasser, aqua fortis). Jedoch wurden viele Schriften Albertus Magnus nur zugeschrieben, um ihnen höheres Gewicht zu verleihen, wahrscheinlich auch die über die Verwendung der Salpetersäure. Später wurde Salpeter mit Eisenvitriol (FeSO4·7 H2O) erhitzt, was höhere Ausbeuten bei niedrigerer Temperatur lieferte. ⓘ
Verwendung
Salpetersäure ist einer der wichtigsten Grundstoffe der chemischen Industrie. Sie dient:
- zur Herstellung von Nitraten und Düngemitteln,
- als Scheidewasser zur Trennung (Quartation) von Gold und Silber (Silber reagiert unter Bildung von löslichem Silbernitrat),
- in Mischungen mit Salzsäure als Königswasser zum Lösen von Gold, sowie zum Vergolden und zum Nachweis von Gold,
- zum Beizen und Brennen von Metallen (grafische und galvanische Technik),
- zum Polieren von Metallen,
- zum Verändern von Fetten (Wasserlöslichkeit) zum Zwecke der Reinigung,
- zur Herstellung von Celluloid, Nitrolacken und Zaponlacken,
- in Raketentreibstoffen als Oxidationsmittel (WFNA und RFNA).
- zur Nitrierung von organischen Stoffen bei der Herstellung von Farbstoffen, Heilmitteln, Desinfektionsmitteln und Explosivstoffen wie Nitroglycerin oder Schießbaumwolle ⓘ
Wegen der letztgenannten Verwendbarkeit zählt die EU Salpetersäure in Gemischen mit einem Gehalt von mehr als 3 % seit 1. Februar 2021 zu den beschränkten Ausgangsstoffen für Explosivstoffe mit der Folge, dass die Verwendung, der Besitz, die Verbringung und die Abgabe durch und an Personen verboten ist, die nicht zu beruflichen oder gewerblichen Zwecken handeln; die berufliche oder gewerbliche Zweckbestimmung ist bei Verkauf zu überprüfen und verdächtige Transaktionen sind meldepflichtig. ⓘ
Nachweis
Salpetersäure kann im Labor wie die Nitrate durch die Ringprobe und durch Lunges Reagenz nachgewiesen werden. ⓘ
Sicherheitshinweise
Salpetersäure wirkt auf Haut, Atemwege und Schleimhäute ätzend. Das Einatmen der Dämpfe kann zu einem toxischen Lungenödem führen. Diese Gefahr besteht vor allem beim Erhitzen oder bei der konzentrierten Säure. In hoher Konzentration ist sie ein starkes Oxidationsmittel und wirkt brandfördernd. Salpetersäure reagiert mit den meisten Metallen unter Bildung von toxischem Stickstoffdioxid. Beim Arbeiten mit Salpetersäure sind eine Schutzbrille oder ein Gesichtsschild, geeignete Schutzhandschuhe und ein geschlossener Arbeitskittel zu tragen. Besteht die Gefahr, dass in einem Raum Salpetersäure-Dämpfe oder Stickoxide frei werden, muss ein Atemschutz-Gerät getragen werden. Salpetersäure eignet sich aus diesem Grund nicht für Reinigungs-Zwecke im Haushalt. Das Arbeiten im Labor erfolgt stets in einem Abzug. Für Flaschen mit konzentrierter Salpetersäure wird ein Teflonverschluss empfohlen. ⓘ







