Trinitrotoluol
|
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugte IUPAC-Bezeichnung
2-Methyl-1,3,5-trinitrobenzol | |||
| Andere Bezeichnungen
2,4,6-Trinitrotoluol
2,4,6-Trinitromethylbenzol 2,4,6-Trinitrotoluol TNT, Tolit, Trilit, Trinitrotoluol, Trinol, Tritolo, Tritolol, Triton, Tritone, Trotol, Trotyl | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| Abkürzungen | TNT | ||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| EC-Nummer |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 0209 - trocken oder angefeuchtet mit < 30% Wasser 0388, 0389 - Gemische mit Trinitrobenzol, Hexanitrostilben | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C7H5N3O6 | ||
| Molekulare Masse | 227,132 g-mol-1 | ||
| Erscheinungsbild | Blassgelber Feststoff. Lose "Nadeln", Flocken oder Prills vor dem Schmelzgießen. Nach dem Gießen in eine Hülle ein fester Block. | ||
| Dichte | 1,654 g/cm3 | ||
| Schmelzpunkt | 80,35 °C (176,63 °F; 353,50 K) | ||
| Siedepunkt | 240,0 °C (464,0 °F; 513,1 K) (zersetzt sich) | ||
Löslichkeit in Wasser
|
0,13 g/L (20 °C) | ||
| Löslichkeit in Ether, Aceton, Benzol, Pyridin | löslich | ||
| Dampfdruck | 0,0002 mmHg (20 °C) | ||
| Explosive Daten | |||
| Schockempfindlichkeit | Unempfindlich | ||
| Reibungsempfindlichkeit | Unempfindlich bis 353 N | ||
| Detonationsgeschwindigkeit | 6900 m/s | ||
| RE-Faktor | 1.00 | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
   
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H201, H301, H311, H331, H373, H411 | ||
Sicherheitshinweise
|
P210, P273, P309+P311, P370+P380, P373, P501 | ||
| NFPA 704 (Feuerdiamant) | |||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (mittlere Dosis)
|
795 mg/kg (Ratte, oral) 660 mg/kg (Maus, oral) | ||
LDLo (niedrigste veröffentlichte Dosis)
|
500 mg/kg (Kaninchen, oral) 1850 mg/kg (Katze, oral) | ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
TWA 1,5 mg/m3 [Haut] | ||
REL (Empfohlen)
|
TWA 0,5 mg/m3 [Haut] | ||
IDLH (Unmittelbare Gefahr)
|
500 mg/m3 | ||
| Sicherheitsdatenblatt (SDS) | ICSC 0967 | ||
| Verwandte Verbindungen | |||
Verwandte Verbindungen
|
Pikrinsäure Hexanitrobenzol 2,4-Dinitrotoluol | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
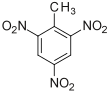
Trinitrotoluol (/ˌtraɪˌnaɪtroʊˈtɒljuiːn/), allgemeiner bekannt als TNT, genauer gesagt 2,4,6-Trinitrotoluol und unter seinem bevorzugten IUPAC-Namen 2-Methyl-1,3,5-Trinitrobenzol, ist eine chemische Verbindung mit der Formel C6H2(NO2)3CH3. TNT wird gelegentlich als Reagenz in der chemischen Synthese verwendet, ist aber vor allem als Sprengstoff mit günstigen Handhabungseigenschaften bekannt. Die Sprengkraft von TNT gilt als Standard für den Vergleich von Bomben und Asteroideneinschlägen. In der Chemie wird TNT zur Erzeugung von Ladungsübertragungssalzen verwendet. ⓘ
Trinitrotoluol (TNT), nach IUPAC-Nomenklatur 2-Methyl-1,3,5-trinitrobenzen, ist ein Sprengstoff. Die Strukturformel der Verbindung zeigt einen Benzolring mit einer Methylgruppe (–CH3) und drei ortho, bzw. para ständige Nitrogruppen (–NO2) als Substituenten. Die Verbindung entsteht durch Nitrierung von Toluol mittels Nitriersäure, einer Mischung von Salpeter- und Schwefelsäure. ⓘ
Erstmals im Jahre 1863 von Julius Wilbrand (1839–1906) synthetisiert, wurde 1901 zunächst im Deutschen Reich mit der Großproduktion von TNT begonnen. Das TNT-Äquivalent dient als Maßstab für die bei einer Explosion freiwerdende Energie. ⓘ
Geschichte
TNT wurde erstmals 1863 von dem deutschen Chemiker Julius Wilbrand hergestellt und ursprünglich als gelber Farbstoff verwendet. Sein Potenzial als Sprengstoff wurde drei Jahrzehnte lang nicht erkannt, vor allem, weil es zu schwierig zu zünden war, weil es weniger empfindlich war als Alternativen. Seine explosiven Eigenschaften wurden erst 1891 von einem anderen deutschen Chemiker, Carl Häussermann, entdeckt. TNT kann gefahrlos in flüssiger Form in Patronenhülsen gegossen werden und ist so unempfindlich, dass es vom britischen Sprengstoffgesetz von 1875 ausgenommen wurde und für die Zwecke der Herstellung und Lagerung nicht als Sprengstoff galt. ⓘ
Die deutschen Streitkräfte übernahmen es 1902 als Füllung für Artilleriegranaten. Mit TNT gefüllte panzerbrechende Geschosse explodierten, nachdem sie die Panzerung britischer Großkampfschiffe durchschlagen hatten, während die mit Lyddit gefüllten britischen Geschosse dazu neigten, beim Auftreffen auf die Panzerung zu explodieren, so dass ein Großteil ihrer Energie außerhalb des Schiffes freigesetzt wurde. Die Briten begannen 1907, Lyddit durch TNT zu ersetzen. ⓘ
Die US-Marine füllte panzerbrechende Granaten weiterhin mit Sprengstoff D, nachdem einige andere Nationen auf TNT umgestiegen waren, begann jedoch, Seeminen, Bomben, Wasserbomben und Torpedoköpfe mit Sprengladungen aus rohem TNT der Klasse B zu füllen, das die Farbe von braunem Zucker hat und zur Detonation eine explosive Verstärkungsladung aus körnigem, kristallisiertem TNT der Klasse A benötigt. Hochexplosive Geschosse wurden mit TNT der Klasse A gefüllt, das für andere Zwecke bevorzugt wurde, als industrielle Chemiekapazitäten für die Entfernung von Xylol und ähnlichen Kohlenwasserstoffen aus dem Toluol-Rohstoff und anderen Nitrotoluol-Isomeren aus den Nitrierungsreaktionen verfügbar wurden. ⓘ
M107 Artilleriegranaten. Alle sind mit der Füllung "Comp B" (Mischung aus TNT und RDX) gekennzeichnet und mit Zündern versehen.
Detonation der 500-Tonnen-TNT-Sprengladung im Rahmen der Operation "Matrosenhut" im Jahr 1965. Die vorbeiziehende Druckwelle hinterlässt eine weiße Wasseroberfläche, über der eine weiße Kondensationswolke zu sehen ist. ⓘ
Nach der ersten Darstellung 1863, der Weiterentwicklung der Synthese durch P. Hepp 1880 und der Entdeckung von TNT als geeignetem Explosivstoff durch Karl Häussermann im Jahr 1889 gelang der Dynamit AG, vormals Alfred Nobel & Co. (DAG) zuerst 1901 im Werk Schlebusch die großtechnische Produktion. Besonders durch den Bedarf des Militärs an TNT als Füllung von Granaten (ab 1902 zuerst im Deutschen Reich) entstanden rasch zahlreiche Fabriken. Der Ausgangsstoff Toluol konnte damals aber nur in begrenzter Menge hergestellt werden, da man auf die Gewinnung aus Steinkohlenteer angewiesen war, einem Gemisch aus Tausenden von Einzelsubstanzen, das bei der Koksgewinnung anfällt. Aus heutiger Sicht ist diese Methode allerdings nicht mehr wirtschaftlich, da der Anteil des Toluols im Steinkohlenteer relativ gering ist. ⓘ
Im Zweiten Weltkrieg wurde TNT wiederum verstärkt produziert. Sogenannte „Schlaffabriken“, darunter das Werk Tanne bei Clausthal-Zellerfeld, wurden schon vor Kriegsanfang errichtet, zumeist mit zweifacher Ausführung der Anlagen, damit bei Zerstörungen und Beschädigungen weiter Sprengstoff hergestellt werden konnte. Die produzierten Mengen hatten drastisch zugenommen. So belief sich die Menge des im Deutschen Reich produzierten TNT auf 18.000 Tonnen pro Monat, während des Krieges wurden insgesamt ca. 800.000 Tonnen hergestellt. Diese Steigerung war möglich, weil das notwendige Edukt nun auch aus Erdöl gewonnen werden konnte. In einem zweistufigen Prozess, dem „Deutschen Verfahren“, wurde das Toluol zunächst einfach nitriert. Das entstandene Mononitrotoluol (MNT) reinigte man von unerwünschten Nebenprodukten und nitrierte erneut, wodurch über 2,4-Dinitrotoluol (DNT) das gewünschte Roh-TNT erzeugt wurde. Nach mehrfachem Waschen und Trocknen konnte es granuliert und dann verarbeitet werden. Sicherheitsmaßnahmen wurden dabei vernachlässigt, um für Nachschub an der Front zu sorgen. Da TNT lange Zeit für ungiftig gehalten wurde, neutralisierte man lediglich die Abfälle und ließ sie in Naturgewässer fließen, wo sie sich teilweise in Form von Schlamm ablagerten und als Rüstungsaltlasten die Umwelt schädigen. Hinsichtlich der unbekannten Toxizität ist bekannt, dass zwischen 1911 und 1915 279 Munitionsarbeiter gestorben sind, weil sie kleine Mengen über Haut und Atemwege aufgenommen hatten. Die beiden größten TNT-Produktionsstätten in Deutschland während des Zweiten Weltkriegs waren die Sprengstofffabriken Allendorf und Hessisch Lichtenau. ⓘ
Herstellung
In der Industrie wird TNT in einem dreistufigen Verfahren hergestellt. Zunächst wird Toluol mit einer Mischung aus Schwefel- und Salpetersäure nitriert, um Mononitrotoluol (MNT) herzustellen. Das MNT wird abgetrennt und anschließend zu Dinitrotoluol (DNT) renitriert. Im letzten Schritt wird das DNT mit einer wasserfreien Mischung aus Salpetersäure und Oleum zu Trinitrotoluol (TNT) nitriert. Die Salpetersäure wird bei der Herstellung verbraucht, aber die verdünnte Schwefelsäure kann rekonzentriert und wiederverwendet werden. Nach der Nitrierung wird TNT durch ein Verfahren namens Sulfatierung stabilisiert, bei dem das rohe TNT mit wässriger Natriumsulfitlösung behandelt wird, um weniger stabile TNT-Isomere und andere unerwünschte Reaktionsprodukte zu entfernen. Das bei der Sulfatierung anfallende Spülwasser wird als Rotwasser bezeichnet und ist ein bedeutender Schadstoff und ein Abfallprodukt der TNT-Herstellung. ⓘ
Die Kontrolle der Stickoxide in der Salpetersäure ist sehr wichtig, da freies Stickstoffdioxid zur Oxidation der Methylgruppe von Toluol führen kann. Diese Reaktion ist stark exotherm und birgt das Risiko einer Durchlaufreaktion, die zu einer Explosion führen kann. ⓘ
Im Labor wird 2,4,6-Trinitrotoluol in einem zweistufigen Verfahren hergestellt. Ein Nitrierungsgemisch aus konzentrierter Salpeter- und Schwefelsäure wird verwendet, um Toluol zu einem Gemisch aus Mono- und Di-Nitrotoluol-Isomeren zu nitrieren, wobei eine sorgfältige Kühlung zur Aufrechterhaltung der Temperatur erfolgt. Die nitrierten Toluole werden dann abgetrennt, mit verdünntem Natriumbicarbonat gewaschen, um Stickstoffoxide zu entfernen, und dann vorsichtig mit einer Mischung aus rauchender Salpetersäure und Schwefelsäure nitriert. ⓘ
Anwendungen
TNT ist einer der am häufigsten verwendeten Sprengstoffe für militärische, industrielle und bergbauliche Anwendungen. TNT wurde in Verbindung mit Hydraulic Fracturing (im Volksmund als Fracking bekannt) verwendet, einem Verfahren zur Gewinnung von Öl und Gas aus Schieferformationen. Bei dieser Technik wird Nitroglycerin in hydraulisch erzeugte Risse verdrängt und zur Explosion gebracht, gefolgt von Bohrlochsprengungen mit pelletiertem TNT. ⓘ
TNT wird unter anderem deshalb geschätzt, weil es unempfindlich gegenüber Stößen und Reibung ist und das Risiko einer versehentlichen Detonation im Vergleich zu empfindlicheren Sprengstoffen wie Nitroglyzerin verringert. TNT schmilzt bei 80 °C (176 °F), also weit unter der Temperatur, bei der es spontan detoniert, so dass es gegossen oder sicher mit anderen Sprengstoffen kombiniert werden kann. TNT ist weder wasserabsorbierend noch wasserlöslich, so dass es auch in feuchten Umgebungen wirksam eingesetzt werden kann. Um zu detonieren, muss TNT durch eine Druckwelle eines Initialsprengstoffs, eines so genannten Sprengstoffverstärkers, ausgelöst werden. ⓘ
Obwohl TNT-Blöcke in verschiedenen Größen erhältlich sind (z. B. 250 g, 500 g, 1.000 g), ist es häufiger in synergetischen Sprengstoffmischungen anzutreffen, die einen variablen Prozentsatz von TNT und anderen Bestandteilen enthalten. Beispiele für TNT-haltige Sprengstoffmischungen sind:
- Amatex (Ammoniumnitrat und RDX)
- Amatol (Ammoniumnitrat)
- Ammonal (Ammoniumnitrat und Aluminiumpulver, manchmal auch Holzkohle).
- Baratol (Bariumnitrat und Wachs)
- Zusammensetzung B (RDX und Paraffinwachs)
- Zusammensetzung H6
- Cyclotol (RDX)
- Ednatol
- Hexanit (Hexanitrodiphenylamin)
- Minol
- Octol
- Pentolith
- Picratol
- Tetrytol
- Torpex
- Tritonal ⓘ
Explosiver Charakter
Bei der Detonation von TNT kommt es zu einer Zersetzung, die der folgenden Reaktion entspricht
- 2 C7H5N3O6 → 3 N2 + 5 H2 + 12 CO + 2 C
sowie einige der Reaktionen
- H
2 + CO → H
2O + C
und
- 2 CO → CO
2 + C.
Die Reaktion ist exotherm, hat aber eine hohe Aktivierungsenergie in der Gasphase (~62 kcal/mol). Die kondensierten Phasen (fest oder flüssig) weisen deutlich niedrigere Aktivierungsenergien von etwa 35 kcal/mol auf, was auf die einzigartigen bimolekularen Zersetzungswege bei höheren Dichten zurückzuführen ist. Wegen der Entstehung von Kohlenstoff haben TNT-Explosionen ein rußiges Aussehen. Da TNT einen Überschuss an Kohlenstoff aufweist, können Sprengstoffgemische mit sauerstoffreichen Verbindungen mehr Energie pro Kilogramm liefern als TNT allein. Im 20. Jahrhundert war Amatol, ein Gemisch aus TNT und Ammoniumnitrat, ein weit verbreiteter militärischer Sprengstoff. ⓘ
TNT kann mit einem Hochgeschwindigkeitszünder oder durch eine wirksame Erschütterung zur Explosion gebracht werden. Viele Jahre lang war TNT der Bezugspunkt für die Zahl der Unempfindlichkeit. TNT hatte einen Wert von genau 100 auf der "F of I"-Skala. Inzwischen wurde der Bezugspunkt durch einen empfindlicheren Sprengstoff namens RDX ersetzt, der einen F von I-Wert von 80 hat. ⓘ
Energiegehalt

Die Detonationswärme, die vom NIST zur Definition einer Tonne TNT-Äquivalent verwendet wird, beträgt 1000 cal/g oder 1000 kcal/kg, 4,184 MJ/kg oder 4,184 GJ/Tonne. Die Energiedichte von TNT wird als Bezugspunkt für viele andere Sprengstoffe verwendet, einschließlich Kernwaffen, deren Energiegehalt in Kilotonnen (~4,184 Terajoule oder 4,184 TJ oder 1,162 GWh) oder Megatonnen (~4,184 Petajoule oder 4,184 PJ oder 1,162 TWh) TNT-Äquivalent gemessen wird. Die Verbrennungswärme beträgt jedoch 14,5 Megajoule pro Kilogramm oder 14,5 MJ/kg oder 4,027 kWh/kg, was voraussetzt, dass ein Teil des TNT-Kohlenstoffs mit Luftsauerstoff reagiert, was beim ersten Ereignis nicht der Fall ist. ⓘ
Zum Vergleich: Schießpulver enthält 3 Megajoule pro Kilogramm, Dynamit enthält 7,5 Megajoule pro Kilogramm, und Benzin enthält 47,2 Megajoule pro Kilogramm (allerdings benötigt Benzin ein Oxidationsmittel, so dass ein optimiertes Benzin-O2-Gemisch 10,4 Megajoule pro Kilogramm enthält). ⓘ
Nachweis
TNT kann mit verschiedenen Methoden nachgewiesen werden, darunter optische und elektrochemische Sensoren und Sprengstoffspürhunde. Im Jahr 2013 konnten Forscher der Indian Institutes of Technology mit Hilfe von Edelmetall-Quantenclustern TNT im subzeptomolaren (10-18 mol/m3) Bereich nachweisen. ⓘ
Sicherheit und Toxizität
TNT ist giftig und kann bei Hautkontakt zu Hautreizungen führen, wodurch sich die Haut leuchtend gelb-orange verfärbt. Während des Ersten Weltkriegs stellten Munitionsarbeiterinnen, die mit der Chemikalie in Berührung kamen, fest, dass sich ihre Haut leuchtend gelb färbte, was ihnen den Spitznamen "Kanarienvogel-Mädchen" oder einfach "Kanarienvögel" einbrachte. ⓘ
Menschen, die TNT über einen längeren Zeitraum ausgesetzt sind, neigen zu Anämie und abnormalen Leberfunktionen. Auch bei Tieren, die Trinitrotoluol aufgenommen oder eingeatmet haben, wurden Blut- und Leberschäden, eine Vergrößerung der Milz und andere schädliche Auswirkungen auf das Immunsystem festgestellt. Es gibt Hinweise darauf, dass TNT die männliche Fruchtbarkeit beeinträchtigt. TNT ist als mögliches Karzinogen für den Menschen aufgelistet, wobei in Tierversuchen mit Ratten krebserregende Wirkungen nachgewiesen wurden, obwohl die Auswirkungen auf den Menschen bisher keine sind (laut IRIS vom 15. März 2000). Der Verzehr von TNT führt zu rotem Urin, da Abbauprodukte vorhanden sind, und nicht zu Blut, wie manchmal angenommen wird. ⓘ
Einige militärische Testgelände sind mit Abwässern aus Munitionsprogrammen kontaminiert, einschließlich der Kontamination von Oberflächen- und Grundwasser, das aufgrund des Vorhandenseins von TNT rosa gefärbt sein kann. Die Beseitigung einer solchen Kontamination, die als "rosa Wasser" bezeichnet wird, kann sich als schwierig und teuer erweisen. ⓘ
TNT neigt zur Ausscheidung von Dinitrotoluolen und anderen Isomeren des Trinitrotoluols, wenn TNT-haltige Geschosse bei höheren Temperaturen in wärmeren Klimazonen gelagert werden. Die Ausscheidung von Verunreinigungen führt zur Bildung von Poren und Rissen (die wiederum eine erhöhte Stoßempfindlichkeit verursachen). Das Eindringen der ausgetretenen Flüssigkeit in das Gewinde des Zünders kann zur Bildung von Feuerkanälen führen, was das Risiko einer unbeabsichtigten Detonation erhöht. Eine Fehlfunktion des Zünders kann auch dadurch entstehen, dass die Flüssigkeit in den Zündermechanismus wandert. Kalziumsilikat wird dem TNT beigemischt, um die Neigung zur Ausschwitzung zu verringern. ⓘ
Rosa und rotes Wasser
Rosa Wasser und rotes Wasser sind zwei verschiedene Arten von Abwässern, die mit Trinitrotoluol in Verbindung stehen. Rosa Wasser entsteht beim Waschen der Ausrüstung nach der Munitionsbefüllung oder Entmilitarisierung und ist im Allgemeinen mit der maximalen Menge an TNT gesättigt, die sich in Wasser auflöst (etwa 150 Teile pro Million (ppm)). Es hat jedoch eine unbestimmte Zusammensetzung, die vom genauen Verfahren abhängt; insbesondere kann es auch Cyclotrimethylentrinitramin (RDX) enthalten, wenn die Anlage TNT/RDX-Gemische verwendet, oder HMX, wenn TNT/HMX verwendet wird. Rotes Wasser (auch "Sellitwasser" genannt) entsteht bei der Reinigung des rohen TNT. Es hat eine komplexe Zusammensetzung mit mehr als einem Dutzend aromatischer Verbindungen, aber die Hauptbestandteile sind anorganische Salze (Natriumsulfat, Natriumsulfit, Natriumnitrit und Natriumnitrat) und sulfonierte Nitroaromaten. ⓘ
Rosa Wasser ist zum Zeitpunkt seiner Entstehung farblos, während rotes Wasser farblos oder sehr blassrot sein kann. Die Farbe entsteht durch photolytische Reaktionen unter dem Einfluss von Sonnenlicht. Trotz der Bezeichnungen handelt es sich bei rotem und rosafarbenem Wasser nicht unbedingt um unterschiedliche Farbtöne; die Farbe hängt hauptsächlich von der Dauer der Sonneneinstrahlung ab. Wenn es lange genug der Sonne ausgesetzt wird, färbt sich "rosa" Wasser dunkelbraun. ⓘ
Wegen der Toxizität von TNT ist die Einleitung von rosa Wasser in die Umwelt in den USA und vielen anderen Ländern seit Jahrzehnten verboten, aber in sehr alten Anlagen kann eine Bodenkontamination bestehen. Die Kontamination mit RDX und Tetryl wird jedoch in der Regel als problematischer angesehen, da TNT eine sehr geringe Bodenmobilität aufweist. Rotes Wasser ist wesentlich giftiger und wird daher seit jeher als gefährlicher Abfall betrachtet. Traditionell wurde es durch Verdampfen bis zur Trockene entsorgt (da die giftigen Bestandteile nicht flüchtig sind), gefolgt von Verbrennung. Es wurde viel Forschung betrieben, um bessere Entsorgungsverfahren zu entwickeln. ⓘ
Ökologische Auswirkungen
Aufgrund seiner Eignung für Bau- und Abbrucharbeiten ist TNT der am weitesten verbreitete Sprengstoff, und daher ist seine Toxizität am besten charakterisiert und wird am häufigsten berichtet. TNT-Rückstände aus der Herstellung, Lagerung und Verwendung können Wasser, Boden, die Atmosphäre und die Biosphäre verschmutzen. ⓘ
Die TNT-Konzentration in kontaminiertem Boden kann bis zu 50 g/kg Boden erreichen, wobei die höchsten Konzentrationen auf oder nahe der Oberfläche zu finden sind. Im September 2001 erklärte die United States Environmental Protection Agency (USEPA) TNT zu einem Schadstoff, dessen Beseitigung Priorität hat. Die USEPA ist der Ansicht, dass die TNT-Konzentration im Boden 17,2 Gramm pro Kilogramm Boden und 0,01 Milligramm pro Liter Wasser nicht überschreiten sollte. ⓘ
Wässrige Löslichkeit
Die Löslichkeit ist ein Maß für die Geschwindigkeit, mit der sich festes TNT in Kontakt mit Wasser auflöst. Die relativ geringe Wasserlöslichkeit von TNT führt dazu, dass feste Partikel über längere Zeiträume kontinuierlich an die Umwelt abgegeben werden. Studien haben gezeigt, dass sich TNT in Salzwasser langsamer auflöst als in Süßwasser. Wird jedoch der Salzgehalt verändert, löst sich TNT mit derselben Geschwindigkeit auf. Da TNT in Wasser mäßig löslich ist, kann es durch den Untergrund wandern und eine Verunreinigung des Grundwassers verursachen. ⓘ
Adsorption des Bodens
Die Adsorption ist ein Maß für die Verteilung zwischen löslichen und im Sediment adsorbierten Schadstoffen nach Erreichen des Gleichgewichts. Es ist bekannt, dass TNT und seine Umwandlungsprodukte an der Oberfläche von Böden und Sedimenten adsorbiert werden, wo sie eine reaktive Umwandlung erfahren oder gespeichert bleiben. Die Bewegung organischer Schadstoffe durch Böden hängt von ihrer Fähigkeit ab, sich mit der mobilen Phase (Wasser) und einer stationären Phase (Boden) zu verbinden. Stoffe, die sich stark mit dem Boden verbinden, bewegen sich langsam durch den Boden. Stoffe, die sich stark mit Wasser assoziieren, bewegen sich durch Wasser mit einer Geschwindigkeit, die der des Grundwassers nahe kommt. ⓘ
Die Assoziationskonstante von TNT mit dem Boden beträgt 2,7 bis 11 l/kg Boden. Das bedeutet, dass TNT eine ein- bis zehnfache Tendenz hat, an Bodenpartikeln zu haften, wenn es in den Boden eingebracht wird. Wasserstoffbrückenbindungen und Ionenaustausch sind zwei vorgeschlagene Mechanismen der Adsorption zwischen den funktionellen Nitrogruppen und den Bodenkolloiden. ⓘ
Die Anzahl der funktionellen Gruppen auf TNT beeinflusst die Fähigkeit, im Boden zu adsorbieren. Es hat sich gezeigt, dass der Adsorptionskoeffizient mit zunehmender Anzahl der Aminogruppen steigt. So war die Adsorption des TNT-Zersetzungsprodukts 2,4-Diamino-6-nitrotoluol (2,4-DANT) größer als die von 4-Amino-2,6-dinitrotoluol (4-ADNT), das wiederum größer war als TNT. Die niedrigeren Adsorptionskoeffizienten für 2,6-DNT im Vergleich zu 2,4-DNT können auf die sterische Hinderung der NO2-Gruppe in der ortho-Position zurückgeführt werden. ⓘ
Untersuchungen haben gezeigt, dass die Adsorption von TNT und seinen Umwandlungsprodukten an Böden und Sedimenten in Süßwasserumgebungen mit hohem Ca2+-Gehalt geringer sein kann als in einer salzhaltigen Umgebung, in der K+ und Na+ dominieren. Bei der Betrachtung der Adsorption von TNT sind daher die Art des Bodens oder Sediments sowie die ionische Zusammensetzung und Stärke des Grundwassers wichtige Faktoren. ⓘ
Es wurden die Assoziationskonstanten für TNT und seine Abbauprodukte mit Tonen bestimmt. Tonminerale haben einen erheblichen Einfluss auf die Adsorption von energetischen Verbindungen. Bodeneigenschaften, wie der Gehalt an organischem Kohlenstoff und die Kationenaustauschkapazität, haben einen erheblichen Einfluss auf die Adsorptionskoeffizienten. ⓘ
Weitere Studien haben gezeigt, dass die Mobilität von TNT-Abbauprodukten wahrscheinlich geringer ist "als die von TNT in unterirdischen Umgebungen, wo die spezifische Adsorption an Tonmineralien den Sorptionsprozess dominiert". Die Mobilität von TNT und seinen Umwandlungsprodukten hängt also von den Eigenschaften des Sorptionsmittels ab. Die Mobilität von TNT im Grundwasser und im Boden wurde aus "Sorptions- und Desorptionsisothermenmodellen, die mit Huminsäuren in Aquifersedimenten und Böden bestimmt wurden" extrapoliert. Aus diesen Modellen geht hervor, dass TNT eine geringe Retention aufweist und leicht in der Umwelt transportiert werden kann. ⓘ
Im Vergleich zu anderen Sprengstoffen hat TNT eine höhere Assoziationskonstante mit dem Boden, d. h. es haftet stärker am Boden als am Wasser. Dagegen können sich andere Sprengstoffe wie RDX und HMX mit niedrigen Assoziationskonstanten (zwischen 0,06 und 7,3 l/kg bzw. 0 und 1,6 l/kg) schneller im Wasser bewegen. ⓘ
Chemischer Abbau
TNT ist ein reaktives Molekül und reagiert besonders leicht mit reduzierten Bestandteilen von Sedimenten oder wird in Gegenwart von Sonnenlicht photochemisch abgebaut. TNT ist thermodynamisch und kinetisch in der Lage, mit einer großen Anzahl von Komponenten vieler Umweltsysteme zu reagieren. Dazu gehören auch rein abiotische Reaktanten wie Photonen, Schwefelwasserstoff, Fe2+ oder mikrobielle Gemeinschaften, sowohl im oxischen als auch im anoxischen Bereich. ⓘ
Es hat sich gezeigt, dass Böden mit einem hohen Tongehalt oder einer geringen Partikelgröße und einem hohen Gehalt an organischem Gesamtkohlenstoff die Umwandlung von TNT fördern. Zu den möglichen TNT-Umwandlungen gehören die Reduktion von einer, zwei oder drei Nitrogruppen zu Aminen und die Kopplung von Amino-Umwandlungsprodukten zur Bildung von Dimeren. Die Bildung der beiden Monoamino-Umwandlungsprodukte, 2-ADNT und 4-ADNT, ist energetisch begünstigt und wird daher in kontaminierten Böden und Grundwasser beobachtet. Die Diamino-Produkte sind energetisch weniger günstig, und noch unwahrscheinlicher sind die Triamino-Produkte. ⓘ
Die Umwandlung von TNT wird unter anaeroben Bedingungen sowie unter stark reduzierenden Bedingungen erheblich verstärkt. Die Umwandlung von TNT in Böden kann sowohl biologisch als auch abiotisch erfolgen. ⓘ
Die Photolyse ist ein wichtiger Prozess, der sich auf die Umwandlung von energetischen Verbindungen auswirkt. Die Veränderung eines Moleküls bei der Photolyse erfolgt durch direkte Absorption von Lichtenergie oder durch die Übertragung von Energie aus einer photosensibilisierten Verbindung. Die Phototransformation von TNT "führt zur Bildung von Nitrobenzolen, Benzaldehyden, Azodicarbonsäuren und Nitrophenolen als Ergebnis der Oxidation von Methylgruppen, der Reduktion von Nitrogruppen und der Bildung von Dimeren." ⓘ
Die Photolyse von TNT lässt sich daran erkennen, dass sich TNT-haltige Abwässer bei Sonneneinstrahlung rosa verfärben. Die Photolyse verläuft in Flusswasser schneller als in destilliertem Wasser. Letztendlich beeinflusst die Photolyse das Schicksal von TNT in erster Linie in der aquatischen Umwelt, könnte aber auch das Schicksal von TNT im Boden beeinflussen, wenn die Bodenoberfläche dem Sonnenlicht ausgesetzt ist. ⓘ
Biologische Zersetzung
Die ligninolytische physiologische Phase und das Manganperoxidase-System von Pilzen können eine sehr begrenzte Mineralisierung von TNT in einer Flüssigkultur bewirken, jedoch nicht im Boden. Ein Organismus, der in der Lage ist, große Mengen von TNT im Boden zu sanieren, muss erst noch entdeckt werden. Sowohl Wild- als auch transgene Pflanzen können Sprengstoffe aus dem Boden und dem Wasser phytosanieren. ⓘ
Eigenschaften
Physikalische Eigenschaften

Trinitrotoluol kann in zwei verschiedenen Modifikationen auftreten (Polymorphie), die sich schon anhand ihrer Farbe unterscheiden lassen. Die stabile, monokline Form bildet hellgelbe, nadelförmige Kristalle, die bei 80,4 °C schmelzen. Eine metastabile, orthorhombische Form bildet orange Kristalle. Beim Erhitzen auf 70 °C erfolgt eine Umwandlung zur monoklinen Form. In Wasser ist die Verbindung sehr schwer löslich, mäßig löslich in Methanol (1 %) und Ethanol (3 %), gut löslich hingegen in Ether, Ethylacetat (47 %), Aceton, Benzol, Toluol (55 %) und Pyridin. Mit seinem niedrigen Schmelzpunkt von 80,4 °C lässt sich TNT in Wasserdampf schmelzen und kann in Formen gegossen werden. Die Verbindung kann im Vakuum destilliert werden. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,37280, B = 3209,208 und C = −24,437 im Temperaturbereich von 503 K bis 523 K. Die Verbindung verträgt eine Dauererhitzung bis 140 °C. Oberhalb von 160 °C setzt eine Gasentwicklung ein. Ab 240 °C tritt eine Verpuffung unter starker Rußentwicklung auf. TNT ist giftig und kann bei Hautkontakt allergische Reaktionen hervorrufen. Es färbt die Haut leuchtend gelborange. ⓘ
Explosionskenngrößen
TNT ist einer der bekanntesten, chemisch homogenen, also nur aus einer Komponente bestehenden, Explosivstoffe. Wie alle homogenen Explosivstoffe verdankt TNT seine Explosivität einer internen chemischen Instabilität und der Bildung wesentlich stabilerer, gasförmiger Produkte bei der Explosion. Der für die Explosion nötige Brennstoff (das Reduktionsmittel in Form der C-Atome) und der Oxidator (das Oxidationsmittel in Form der Nitrogruppen) sind dabei im TNT-Molekül selbst enthalten. Aus chemischer Sicht spricht man bei der Explosion von einer intramolekular sehr schnell und exotherm ablaufenden Redoxreaktion, die durch eine Initialzündung gestartet wird. Die entstehenden stabileren und energieärmeren Produkte sind z. B. Stickstoff, Kohlenstoffdioxid, Methan, Kohlenmonoxid und Cyanwasserstoff. Letztere Produkte können wegen des zu geringen Sauerstoffanteils im Molekül entstehen. ⓘ
Wurde am Beginn eine ausreichende Menge der Substanz gezündet, erhält die abgegebene Energie die Reaktion aufrecht und die gesamte Stoffmenge reagiert. Die Umsetzung erfolgt dabei in einer sehr schnellen, schmalen Reaktionszone, welche die Substanz wie eine Welle durchläuft. Die Geschwindigkeit dieser Reaktionszone erreicht bei leistungsfähigen Explosivstoffen mehrere tausend Meter pro Sekunde, überschreitet also die innerstoffliche Schallgeschwindigkeit. Durch die freigesetzte Energie und die Entstehung von Gasen als Reaktionsprodukte kommt es zu einem extrem steilen Druck- und Temperaturanstieg, was die Wirksamkeit brisanter Sprengstoffe begründet. ⓘ
Wichtige sicherheitstechnische Kenngrößen zum Explosionsverhalten sind:
- Explosionswärme: 3725 kJ·kg−1 (H2O (l)), 3612 kJ·kg−1 (H2O (g))
- Normalgasvolumen: 975 l·kg−1
- Detonationsgeschwindigkeit: 6900 m/s (Dichte: 1,6 g/cm3)
- Bleiblockausbauchung: 30 cm3/g
- Verpuffungspunkt: 300 °C
- Schlagempfindlichkeit: 15 Nm (1,5 kpm)
- Reibempfindlichkeit: bis 353 N (36 kp) keine Reaktion
- Grenzdurchmesser beim Stahlhülsentest: 5 mm ⓘ
Verwendung
TNT ist noch heute ein wichtiger militärischer Sprengstoff. Verwendet wird er militärisch und gewerblich in Mischungen als Sicherheitssprengstoff, der nur durch Initialzündung (beispielsweise durch eine Sprengkapsel) zur Detonation gebracht werden kann. Gegossenes TNT benötigt zur sicheren Zündung sogar eine Verstärkerladung, den so genannten Booster. TNT allein wird durch Brand oder Hitze nicht explodieren; es brennt einfach ab. Aufgrund seiner hohen Herstellungskosten (etwa das 20fache gewerblicher Sprengstoffe) ist sein Haupteinsatz im militärischen Bereich (Sprengmittel besonders in Granaten, Bomben und Minen). ⓘ
Gründe für die breite Verwendung sind die vergleichsweise vielfältigen und sicheren Verarbeitungs- und Anwendungsmöglichkeiten. Im Gegensatz zu vielen anderen Sprengstoffen lässt sich TNT nahezu ohne die Gefahr der Umsetzung verflüssigen und gießen und in Formen pressen. ⓘ
Der Energiegehalt beträgt in SI-Einheiten:
- 1 kg TNT ≙ 4,6 Megajoule (4,6 · 106 Joule). Zum Vergleich: Brennholz hat einen 3 bis 4 Mal höheren Energiewert. ⓘ
Die im Zusammenhang mit Kernwaffenexplosionen verwendete Einheit TNT-Äquivalent basiert auf der veralteten Einheit Kalorie und ist definiert durch ⓘ
- 1 kT (Kilotonne TNT) ≙ 1012 cal = 4,184 · 1012 J. ⓘ
- Die Einheiten Megatonne und Gigatonne sind analog definiert. Durch die Großschreibung (Symbol T) soll die Verwechselung mit der Masseneinheit Tonne (Symbol kleingeschriebenes t) verhindert werden. ⓘ
Chemisch verwandte Sprengstoffe
- Trinitrobenzol
- Pikrinsäure ⓘ